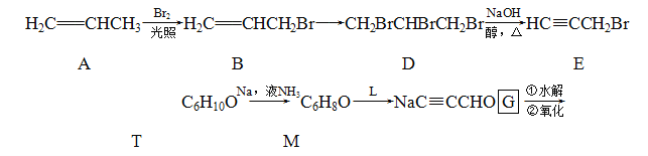题目内容
【题目】利用海水提取溴和镁的一般过程如下,下列说法正确的是( )
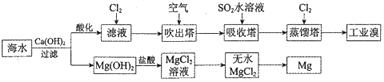
A. 工业溴中含少量Cl2,可用NaOH溶液除去
B. 工业上常利用电解MgCl2溶液冶炼金属镁
C. 富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D. 若提取1molBr2,至少需要44.8L的Cl2
【答案】C
【解析】分析:A.溴能与氢氧化钠反应;
B.根据镁是活泼的金属分析;
C.根据液溴易挥发解答;
D.根据流程图中氯气参与的反应分析计算,注意气体摩尔体积的使用条件和范围。
详解:A.由于Br2能与NaOH溶液反应,因此用NaOH溶液吸收Cl2的同时,Br2也被吸收,A错误;
B.镁是活泼的金属,工业上常用电解熔融的MgCl2冶炼金属镁,惰性电极电解MgCl2溶液生成氯气、氢气和氢氧化镁,B错误;
C.溴易挥发,因此在富集溴元素的过程中,可以使用空气吹出法,C正确;
D.溶液酸化之后得到的滤液中Br-与氯气发生反应,生成1molBr2,需要1molCl2,然后1molBr2在吹出塔富集,并在吸收塔中被SO2还原成2molBr-,然后在蒸馏塔中Cl2再次将2molBr-氧化成1molBr2,因此整个过程若提取1molBr2,至少需要2mol氯气,标准状况下为44.8 L,D错误。答案选C。

练习册系列答案
相关题目