题目内容
【题目】某同学利用下列实验探究金属铝与铜盐溶液的反应:
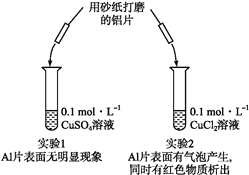
下列说法正确的是( )
A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜
B. 实验2中生成红色物质的离子方程式为Al+Cu2+![]() Al3++Cu
Al3++Cu
C. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
D. 由上述实验可推知:用砂纸打磨后的铝片分别与H+浓度均为0.2 mol·L-1的盐酸和硫酸溶液反应,后者更剧烈
【答案】C
【解析】试题分析:A.没有明显现象,只能说明反应没发生,客观事实是金属活泼性是铝大于铜,故A错误;B.生成红色固体的反应是2Al3+Cu2+═2Al3++3Cu,故B错误;C.由实验1、2 的对比实验可知产生不同现象的原因是溶液中的阴离子不同导致的,故C正确;D.铝片在等浓度的盐酸和硫酸中反应,因硫酸中的H+的浓度大,所以在硫酸中反应剧烈,与本实验无关,故D错误;故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 滴入稀HNO3同时用pH计测定至溶液呈中性 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③ B.②③④ C.①③④ D.①②③④

