题目内容
5.利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO.制备流程图如下: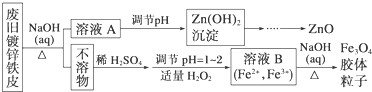
已知:Zn及其化合物的性质与Al及其化合物的性质相似,请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有AB.
A.去除油污 B.溶解镀锌层C.去除铁锈 D.钝化
(2)由溶液B制取Fe3O4胶体粒子的过程中,须持续通入N2,其原因是在N2气氛下,防止Fe2+被氧化.
(3)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量,发生的离子反应是:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.现取3.50g产物Fe3O4进行测定,滴定终点时,耗浓度为0.0100mol•L-1的K2Cr2O7标准溶液250mL,则产物Fe3O4中二价铁的质量百分含量为24.0%.(计算结果保留3位有效数字).
(4)配制标准溶液时,下列仪器中不必要用到的有③④(用编号表示).
①电子天平 ②烧杯 ③量筒 ④锥形瓶 ⑤容量瓶 ⑥胶头滴管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将偏大(填“偏大”、“偏小”或“不变”).
分析 废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,调节溶液PH生成氢氧化锌沉淀,过滤、洗涤、灼烧得到氧化锌,不溶物为铁,溶于稀硫酸加入适量过氧化氢,调节溶液PH=1~2,部分氧化亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,加热促进水解生成四氧化三铁胶体粒子;
(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用;
(2)持续通入N2,防止Fe2+被氧化;
(3)根据离子方程式定量关系计算得到亚铁离子的物质的量,计算得到亚铁离子的质量分数;
(4)根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,容量瓶用于配置溶液,胶头滴管用于加水定容;
(5)根据对K2Cr2O7标准溶液体积的影响分析,滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,读取标准溶液体积会偏大,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$.
解答 解:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,调节溶液PH生成氢氧化锌沉淀,过滤、洗涤、灼烧得到氧化锌,不溶物为铁,溶于稀硫酸加入适量过氧化氢,调节溶液PH=1~2,部分氧化亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,加热促进水解生成四氧化三铁胶体粒子;
(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,
故答案为:AB;
(2)持续通入N2,防止Fe2+被氧化;
故答案为:在N2气氛下,防止Fe2+被氧化;
(3)现取3.50g产物Fe3O4进行测定,滴定终点时,耗浓度为0.0100mol•L-1的K2Cr2O7标准溶液250mL,
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
1 6
0.0100mol•L-1×0.25L n(Fe2+)
n(Fe2+)=0.015mol
则产物Fe3O4中二价铁的质量百分含量为$\frac{0.015×56}{3.5}$×100%=24.0%,
故答案为:24.0%;
(4)根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,容量瓶用于配置溶液,胶头滴管用于加水定容,不必要用到的有③量筒 ④锥形瓶,
故答案为:③④;
(5)如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,这样就造成读数偏小;滴定结束后气泡消失,这样读数就正常,所以读出来的K2Cr2O7标准溶液体积偏大,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,测定结果将偏大,
故答案为:偏大.
点评 本题以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查实验基本操作和技能,涉及标准溶液的配制及滴定的误差分析、对信息的利用、实验条件的控制等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | S | B. | H2S | C. | SO2 | D. | SO3 |
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
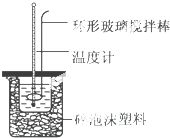 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据| 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8 kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏大(填“偏大”、“偏小”或“不变”).
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABE.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大.
| A. | CH3CH2Br$\stackrel{NaOH水溶液}{→}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
| A. | C2H2 | B. | C2H6O | C. | C4H6 | D. | C2H4 |
 .
. ,该化合物是由离子键形成.
,该化合物是由离子键形成.