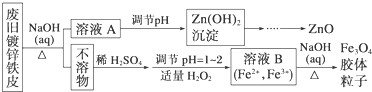
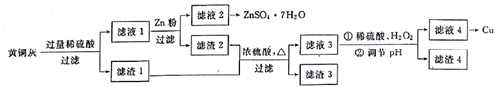
题目内容
2.下列实验方案的设计、结论正确的是( )| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
分析 A.NaHCO3 溶液分别与稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液混合的现象为:气体生成、无现象、气体和沉淀生成、沉淀生成;
B.黑色物质为二氧化锰,与稀盐酸不反应;
C.二者均与Na2SO3 溶液反应;
D.水温下降,可能为溶解时吸热.
解答 解:A.NaHCO3 溶液分别与稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液混合的现象为:气体生成、无现象、气体和沉淀生成、沉淀生成,现象不同,可鉴别,故A正确;
B.黑色物质为二氧化锰,与稀盐酸不反应,应选浓盐酸、加热洗涤,故B错误;
C.二者均与Na2SO3 溶液反应,应选饱和NaHSO3 溶液除杂,故C错误;
D.水温下降,可能为溶解时吸热,则不能说明硝酸铵水解是吸热的,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的鉴别、仪器的洗涤、混合物分离提纯、反应中的热效应及盐类水解等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
10.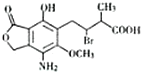 某有机物M的结构简式如图所示,若等物质的量的M在一定条件下分别与金属钠、氢氧化钠溶液、碳酸氢钠溶液反应,则消耗的钠、氢氧化钠、碳酸氢钠的物质的量之比为( )
某有机物M的结构简式如图所示,若等物质的量的M在一定条件下分别与金属钠、氢氧化钠溶液、碳酸氢钠溶液反应,则消耗的钠、氢氧化钠、碳酸氢钠的物质的量之比为( )
 某有机物M的结构简式如图所示,若等物质的量的M在一定条件下分别与金属钠、氢氧化钠溶液、碳酸氢钠溶液反应,则消耗的钠、氢氧化钠、碳酸氢钠的物质的量之比为( )
某有机物M的结构简式如图所示,若等物质的量的M在一定条件下分别与金属钠、氢氧化钠溶液、碳酸氢钠溶液反应,则消耗的钠、氢氧化钠、碳酸氢钠的物质的量之比为( )| A. | 1:1:1 | B. | 2:4:1 | C. | 1:2:1 | D. | 1:2:2 |
7.化学与社会、生活密切相关,下列现象或事实与对应的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 蔗糖、淀粉、纤维素等有甜味 | 人体内,糖类在淀粉酶的作用下能发生水解,生成葡萄糖 |
| B | 煤通过气化和液化等化学变化可以有效地控制酸雨 | 煤通过气化和液化处理,其产品中硫的含量将大大降低 |
| C | 地沟油经过处理加工后可用作飞机、汽车燃油 | 地沟油的成分是液态烃 |
| D | 在钢铁制品的表面镀上一层锡,可有效防止其被腐蚀 | 形成原电池时锡是负极被氧化,而钢铁制品作为正极被保护 |
| A. | A | B. | B | C. | C | D. | D |
3.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)写出Z在元素周期表中的位置第三周期第ⅣA 族.
(2)X的最高价氧化物的电子式为 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)W的最高价氧化物对应的水化物属于共价化合物,(填“离子”或“共价”),W和Z形成的气态氢化物的稳定性大小关系是:NH3>SiH4.(用化学式表示)
W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似(醋酸为一元弱酸),体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH=NaN3+H2O(方程式中各物质用化学式表示)
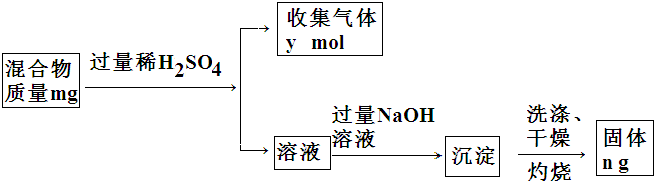
(4)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y
| W | X | Y | Z | |
| 结构或 性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
(2)X的最高价氧化物的电子式为
 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.(3)W的最高价氧化物对应的水化物属于共价化合物,(填“离子”或“共价”),W和Z形成的气态氢化物的稳定性大小关系是:NH3>SiH4.(用化学式表示)
W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似(醋酸为一元弱酸),体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH=NaN3+H2O(方程式中各物质用化学式表示)
(4)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y

 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: