��Ŀ����
����Ŀ����1��ȼ�ϵ����һ�ָ�Ч�������Ѻõķ���װ�á�����ȼ�ϵ�������ں���ɻ���������������ҺΪ�������Һ�����ֵ�صĸ�����ӦʽΪ_______________�����ֵ���ڷŵ�ʹ��һ��ʱ��������Һ�е�c��OH������___________���������С�� ���䡱����
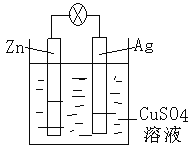
��2����ͼ����пԭ���װ�õ�ʾ��ͼ��������ͭΪ�������Һ���ش��������⣺пΪ_______�����õ缫�Ϸ���_________��Ӧ������������ԭ�������缫��ӦʽΪ__________����ԭ��ص��ܷ�Ӧ���ӷ���ʽΪ__________________________________��
��.һ���¶��½�6mol��A��6molB�����2L���ܱ�������,�������·�:3A��g��+B��g��![]() xC��g��+2D��g��,����5���Ӻ�Ӧ�ﵽƽ��,���A��ת����Ϊ60%,C��ƽ����Ӧ������0.36mol/��L��min������:
xC��g��+2D��g��,����5���Ӻ�Ӧ�ﵽƽ��,���A��ת����Ϊ60%,C��ƽ����Ӧ������0.36mol/��L��min������:
��1��ƽ��ʱD��Ũ��=________��
��2��B��ƽ����Ӧ����v��B��=____________��
��3��x=________________��
��4����ʼʱ�����е�ѹǿ��ƽ��ʱ��ѹǿ֮��Ϊ_______����Ϊ��������ȣ���
��5����NH3���������з�ȼ�ϵ���ǵ�ǰ���е�һ���ȵ㡣ʹ�õĵ������Һ��2mol��L-1��KOH��Һ������ܷ�ӦΪ��4NH3+3O2��2N2+6H2O���õ�ظ����ĵ缫��Ӧ__________��ÿ����3.4gNH3ת�Ƶĵ�����ĿΪ__________��
���𰸡�2H2+4OH��-4e����4H2O ��С ���� ���� Zn-2e-��Zn2+ Zn+Cu2+��Cu+Zn2+ 1.2mol/L 0.12mol/��L��min�� 3 10:11 2NH3-6e-+6OH-��N2+6H2O 0.6NA
��������
��.��1��ͨ��������һ��Ϊ��صĸ���������ʧ���ӷ���������Ӧ������ˮ�����ĵ缫����ʽΪ2H2+4OH--4e-��4H2O������ʱ���ܷ�ӦΪ2H2+O2��2H2O����Ӧ����ˮ��Һ�����������c��OH-������С��
��2����ͼ��֪��ZnΪ�����������ϵ缫��ӦʽΪZn-2e-=Zn2+��ʧȥ���ӱ�������Ϊ������Ӧ��AgΪ�����������ϵ缫��ӦʽΪCu2++2e-=Cu����ԭ��ص��ܷ�Ӧ���ӷ���ʽΪZn+Cu2+=Cu+Zn2+��
��.��Ӧ3A��g��+B��g��![]() xC��g��+2D��g������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%����
xC��g��+2D��g������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%����
3A��g��+B��g��![]() xC��g��+2D��g��
xC��g��+2D��g��
��ʼ��mol/L��3 3 0 0
ת����mol/L��3��60% 0.6 0.6x 1.2
ƽ�⣨mol/L��1.2 2.4 0.6x 1.2
��1��������������֪ƽ��״̬D��Ũ��Ϊ1.2mol/L���ʴ�Ϊ��1.2��
��2��B��ƽ����Ӧ��������B��=0.6mol/L��5min=0.12mol/��L��min����
��3��������֮�ȵ��ڻ�ѧ������֮�ȿ�֪��1/x=0.12/0.36�����x=3��
��4����ʼʱ�����е�ѹǿ��ƽ��ʱ��ѹǿ֮�ȵ��ڷ�Ӧǰ������ʵ���֮�͵ıȣ�Ϊ��6+6��mol����1.2+2.4+0.6��3+1.2��mol/L��2L=10��11���ʴ�Ϊ��10��11��
��5����ط�ӦΪ��4NH3+3O2=2N2+6H2O���õ�ظ����ǰ���ʧ�������ɵ�������Ӧ�ĵ缫��ӦʽΪ2NH3+6OH--6e-=N2+6H2O����Ӧ��2mol������Ӧ����ת��6mol���ӣ�ÿ����3.4g NH3���ʵ���0.2nol��ת�Ƶĵ�����Ϊ0.6NA��