题目内容
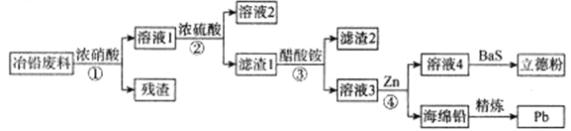
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制各水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
步骤1:制备NaC1O溶液。已知:3NaC1O![]() NaC1+NaC1O3
NaC1+NaC1O3

(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_______(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是__________;若装置C中出现堵塞,玻璃管a中的现象为_______________;B中用冰水浴控制温度在30℃以下,其主要目的是______________。
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaC1O=N2↑+3H2O+2NaC1)。
(3)分液漏斗中的溶液是___________(填“A”或“B”);
A.NaOH和NaC1O混合溶液 B.CO(NH2)2溶液

步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为_______________。
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500 mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为_______________________________________;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为__________。(保留三位有效数字)
【答案】BD MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O 液面上升 防止NaClO分解为NaCl和NaClO3,影响水合肼的产率 A N2H6Cl2 N2H4·H2O+2I2=N2↑+4HI+H2O 25.0%
【解析】
装置A:二氧化锰与浓盐酸反应制取氯气,制取的氯气中含有氯化氢,装置B中玻璃管a的作用为平衡压强,氯气与氢氧化钠反应制备NaClO,Ⅱ中用冰水浴控制温度在30℃以下,防止NaClO(歧化)分解为氯酸钠和氯化钠,装置C进行尾气处理。
(1)根据配制一定质量分数的溶液的步骤选用仪器;
(2)B中氯气与氢氧化钠反应制备NaClO;B中玻璃管a的作用平衡压强,制取的氯气中含有氯化氢,为了提高NaClO的产率,需对A中产生的Cl2进行净化,由已知信息可知,在反应极易发生副反应,B中用冰水浴控制温度在30℃以下,这样做的目的是减少副反应的发生,提高水合肼的产率;
(3) N2H4H2O具有强还原性,容易被过量的NaClO氧化确定仪器A中试剂;
(4)模拟NH3与HCl反应产生的盐书写水合肼与HCl反应产生的盐的化学式;
(5) ①利用电子守恒、原子守恒结合题意,写出反应的化学方程式;
②根据①方程式进行计算。
(1)配制30%NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,合理选项为BD;
(2)装置A中浓盐酸与MnO2混合加热制取氯气,发生反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;若C中发生堵塞时,B中气体压强增大,B中液体进入长玻璃管中,使长玻璃管中液面上升,形成水柱;若温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,导致物质不纯,所以冰水浴温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠,影响水合肼的产率;
Mn2++Cl2↑+2H2O;若C中发生堵塞时,B中气体压强增大,B中液体进入长玻璃管中,使长玻璃管中液面上升,形成水柱;若温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,导致物质不纯,所以冰水浴温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠,影响水合肼的产率;
(3)在三颈烧瓶发生反应:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl ,N2H4H2O具有强还原性,容易被过量的NaClO氧化,所以分液漏斗中盛有NaOH+NaC1O;
(4)水合肼属于二元弱碱。水合肼与盐酸产生的盐为N2H6Cl2;
(5)①水合肼具有还原性,其被I2氧化的方程式为N2H4·H2O+2I2=N2↑+4HI+H2O
②设馏分中水合肼(N2H4H2O)的质量分数为a,则根据反应方程式:
N2H4H2O + 2I2 = N2↑ + 4HI + H2O
50g 2mol
0.3000g×a 0.020L×0.15mol/L
50g:0.3000g×a=2mol:0.020L×0.15mol/L,解得:a=25%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案