题目内容
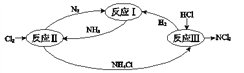
【题目】NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍,工业上用C1O2气体制NaClO2的工艺流程如下:

己知:NaClO2饱和溶液在低于38℃时析出NaC1O2·3H2O,高于38℃时析出NaClO2
下列说法不正确的是
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
C. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
【答案】C
【解析】吸收器中二氧化氯、氢氧化钠、双氧水反应生成NaClO2,离子方程式为:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O,故A正确;低于38℃时析出NaC1O2·3H2O,所以要得到NaClO2,需要蒸发结晶、趁热过滤,故B正确;温度升高双氧水分解,降低提高反应物的利用率,故C错误;通入一定量空气可以驱赶出ClO2,使其被充分吸收,故D正确。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目