题目内容
【题目】为分析某盐的成分, 做了如下实验:
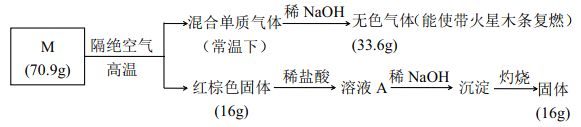
请回答:
(1)盐 M 的化学式是_________;
(2)被 NaOH 吸收的气体的电子式____________;
(3)向溶液 A 中通入H2S 气体, 有淡黄色沉淀产生, 写出反应的离子方程式________ (不考虑空气的影响)。
【答案】 Fe(ClO4)3 ![]() 2Fe3++H2S=2Fe2++2H++S↓
2Fe3++H2S=2Fe2++2H++S↓
【解析】![]() ,证明有氧气产生。能被氢氧化钠吸收的气体为Cl2.,说明含有O和Cl元素,
,证明有氧气产生。能被氢氧化钠吸收的气体为Cl2.,说明含有O和Cl元素,![]() 说明红棕色固体为Fe2O3,说明含有Fe元素。根据数值关系知Fe2O3为0.1mol, O2为33.6L/22.4L.mol-1=1.5mol。含Cl为70.9g-1.5
说明红棕色固体为Fe2O3,说明含有Fe元素。根据数值关系知Fe2O3为0.1mol, O2为33.6L/22.4L.mol-1=1.5mol。含Cl为70.9g-1.5![]() 32g/mol-16g=6.9g,通过确定个原子的物质的量比,确定去分子式为Fe(ClO4)3
32g/mol-16g=6.9g,通过确定个原子的物质的量比,确定去分子式为Fe(ClO4)3
(2)被 NaOH 吸收的气体为氯气,其电子式为:![]() 。
。
(3)A为FeCl3溶液,向溶液 A 中通入 H2S 气体, 有淡黄色沉淀产生,反应的离子方程式
2Fe3++H2S=2Fe2++2H++S↓

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/(kJ/mol) | 351.5 | 463 | 393 | 293 |
则该反应的ΔH=________kJ/mol。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①下列说法不能判断该反应达到化学平衡状态的是________。
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
③某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式__________________。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7/span> |
HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应的平衡常数K=_____________。
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线_______________。