题目内容
2.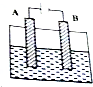 根据下列装置图,回答问题.
根据下列装置图,回答问题.(1)若A,B均为惰性电极,电解质溶液为MgCl2溶液.
阳极:2Cl--2e-=Cl2↑;
阴极:2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑;
总反应式:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓.
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液.
阳极Cu-2e-=Cu2+,阴极Cu2++2e-=Cu.
(3)若A为碳棒,B为铁,电解质为熔融NaCl.
阳极2Cl--2e-=Cl2↑;阴极:Na++e-=Na;
总反应式2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
分析 (1)电解氯化镁溶液,阳极生成氯气,阴极生成氢气和氢氧化镁沉淀;
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液,为电镀铜装置;
(3)若A为碳棒,B为铁,电解质为熔融NaCl,阳极生成氯气,阴极生成钠.
解答 解:(1)电解氯化镁溶液,阳极生成氯气,阴极生成氢气和氢氧化镁沉淀,阳极反应为2Cl--2e-=Cl2↑,阴极反应为2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑,总反应式为Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓,
故答案为:2Cl--2e-=Cl2↑;2H2O+2e-+Mg2+=Ma(OH)2↓+H2↑;Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓;
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液,为电镀铜装置,阳极反应为Cu-2e-=Cu2+,阴极反应为Cu2++2e-=Cu,
故答案为:Cu-2e-=Cu2+;Cu2++2e-=Cu;
(3)若A为碳棒,B为铁,电解质为熔融NaCl,阳极生成氯气,电极方程式为2Cl--2e-=Cl2↑,阴极生成钠,电极放出为Na++e-=Na,总方程式为2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,
故答案为:2Cl--2e-=Cl2↑;Na++e-=Na;2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
点评 本题考查了电解池原理,能正确判断电解池的阴阳极是解本题的关键,注意把握阴阳极上离子的放电顺序,题目难度中等.

练习册系列答案
相关题目
12.下列几种氢键:①O-H…O、②N-H…N、③F-H…F、④O-H…N,按氢键从强到弱的顺序正确的是( )
| A. | ③>①>④>② | B. | ①>②>③>④ | C. | ③>②>①>④ | D. | ①>④>③>② |
13.如图所示,在常温下,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )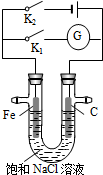

| A. | K1闭合,铁棒上发生的反应为2H++2e-═H2↑ | |
| B. | K1闭合,石墨棒周围溶液pH逐渐降低 | |
| C. | K2闭合,铁棒不易被腐蚀,电路中通过0.001NA个电子时,摇匀后溶液的pH为11 | |
| D. | K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
10.下列化合物的化学键中,只有离子键的是( )
| A. | NH4Cl | B. | Na2CO3 | C. | MgCl2 | D. | K2SO4 |
7.中共中央、国务院于2015年5月5日发布了《关于加快生态文明建设的意见》,5月6日北京市公布禁止露天烧烤地点,取缔各类露天烧烤.下列说法正确的是( )
| A. | 在烧烤过程中,肉类中的蛋白质在高温下发生变性 | |
| B. | 有部分烧烤摊使用了地沟油,地沟油经过精炼后可以食用 | |
| C. | 为了食品卫生,鼓励烧烤摊大量使用一次性竹签 | |
| D. | 露天烧烤产生的大量PM2.5能在空气中形成胶体 |
14.依照阿佛加德罗定律,下列叙述错误的是( )
| A. | 同温同压下两种气体的体积之比等于物质的量之比 | |
| B. | 同温同压下两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同体积下两种气体的物质的量之比等于压强之比 |
11.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L SO3中原子数目为4NA | |
| B. | 100mL 1mol•L-1的K2CO3溶液中CO32-数目为0.1NA | |
| C. | 5.6g N2与足量H2反应,转移电子数目小于1.2NA | |
| D. | 9.1g苯和立方烷(C8H8)的混合物中原子数目为0.7NA |
17.下列关于有机物的说法中正确的是( )
| A. | 甲烷、一氯甲烷、二氯甲烷等均属于烷烃 | |
| B. | 乙醇不与任何酸反应 | |
| C. | 乙酸不能与金属Na反应 | |
| D. | 乙酸乙酯能发生水解反应 |