题目内容
12.下列几种氢键:①O-H…O、②N-H…N、③F-H…F、④O-H…N,按氢键从强到弱的顺序正确的是( )| A. | ③>①>④>② | B. | ①>②>③>④ | C. | ③>②>①>④ | D. | ①>④>③>② |
分析 氢键强弱与形成氢键的元素的电负性大小有关,元素的电负性大的形成的氢键越强.
解答 解:F、O、N三种元素的非金属性依次减弱,所以电负性依次减小,所以F-H,O-H,N-H结合非金属的能力依次减弱,因此氢键的强弱顺序为F>O>N;对与O-H…N,N-H…N的比较,可以从得电子的能力来看,由于O的得电子能力大于N,因此O-H的电子云与N-H的电子云相比,O-H的电子云更偏向O,远离H,因此在O-H…N,N-H…N的氢键中,N-H…N的氢键更弱些,
故选A.
点评 本题考查了氢键强弱的判断,题目难度不大,理解氢键形成的条件是解题的关键,注意抓住元素电负性大小进行比较.

练习册系列答案
相关题目
2.下列分子中,碳原子全部以sp杂化轨道成键的是( )
| A. | 乙烷 | B. | 乙炔 | C. | 苯 | D. | 乙醛 |
3.下列不能用来鉴别甲烷与乙烯的是( )
| A. | 通入酸性高锰酸钾溶液中 | B. | 通入足量溴水中 | ||
| C. | 一定条件下通入H2 | D. | 点燃 |
20.下列说法正确的是( )
| A. | 离子晶体中可能含有共价键,但不一定含有金属元素 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 非极性分子中一定存在非极性键 | |
| D. | 对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔、沸点越高 |
17.将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为(已知NO+NO2+2NaOH═2NaNO2+H2O,2NO2+2NaOH═NaNO3+NaNO2+H2O)( )
| A. | 0.8mol | B. | 0.6mol | C. | 0.2mol | D. | 1.0mol |
4.保护环境,就是保护人类自己.目前,在我国的城市环境中最主要的大气污染物是( )
| A. | CO2、Br2、Cl2、酸雨 | B. | NH3、CO2、NO2、雾 | ||
| C. | HCl、SO2、N2、粉尘 | D. | SO2、NO2、CO、烟尘 |
1.下列关于乙烯的说法正确的是( )
| A. | 分子中的6个原子在同一平面上 | |
| B. | 通常状况下,是易溶于水的气体 | |
| C. | 与酸性高锰酸钾溶液的反应是加成反应 | |
| D. | 不能发生燃烧反应和加聚反应 |
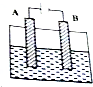 根据下列装置图,回答问题.
根据下列装置图,回答问题.