题目内容
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
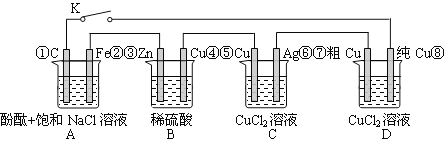
A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
【答案】A
【解析】
试题分析:根据装置可判断,B装置是原电池,其中锌是负极,铜是正极,A、C、D是电解池。A、当K闭合时,A装置中的铁与负极相连,做阴极,铁被保护,A不正确;B、当K断开时,B装置锌片直接与稀硫酸反应,锌溶解,有氢气产生,B正确;C、当K闭合后,B装置是原电池,其中锌是负极,铜是正极,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②,C正确;D、当K闭合后,A装置是电解池,反应中有氢氧化钠生成,pH变大。B装置是原电池,氢离子放电,因此溶液的pH变大,C装置相当于电镀,D装置是粗铜的精炼,因此C、D装置中 pH不变,D正确,答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是(_____)

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
C. | 硫酸亚铁溶液 | 过氧化钠 | 形成黄色溶液 |
D. | 硫酸铁溶液 | 氢硫酸溶液 | 产生黄色浑浊 |
A. A B. B C. C D. D
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |

A.A
B.B
C.C
D.D
【题目】市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装日期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,
kI O3+5KI+3H2 SO4=3K2 SO4+3I2+3H2O
上述反应生成的I2可用四氯化碳检验:确认有I2生成的现象是
利用Na2SO3稀溶液,将I2还原,可从碘的四氯化碳溶液中回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式为 .
(2)已知:I2+2S2O32﹣=2I-+S4O62﹣某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10﹣3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中恰好完全反应依据的现象是 .
(3)②b中反应所产生的I2的物质的量是多少?(写出计算过程)
(4)③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg).(写出计算过程)