题目内容
6.下列溶液中通入SO2无明显现象的是( )| A. | Ba(OH)2 | B. | Ba(NO3)2 | C. | 溴水 | D. | BaCl2 |
分析 A、二氧化硫通入氢氧化钡溶液反应生成亚硫酸钡沉淀;
B、二氧化硫通入Ba(NO3)2 溶液,二氧化硫和水反应生成亚硫酸,溶液中形成稀硝酸具有氧化性氧化二氧化硫为硫酸,生成硫酸钡沉淀;
C、二氧化硫具有还原性,被溴单质氧化为硫酸,溴水褪色;
D、二氧化硫与氯化钡溶液不反应;
解答 解:A、二氧化硫通入氢氧化钡溶液反应生成亚硫酸钡沉淀,继续通入沉淀消失,故A不符合;
B、二氧化硫和水反应生成亚硫酸,溶液中形成稀硝酸具有氧化性氧化二氧化硫为硫酸,溶液中生成硫酸钡沉淀,故B不符合;
C、二氧化硫具有还原性,被溴单质氧化为硫酸,溴单质被还原,溴水褪色,故C不符合;
D、二氧化硫与氯化钡溶液不反应,无明显现象,故D符合;
故选D.
点评 本题考查了二氧化硫性质的理解应用主要是二氧化硫的还原性分析应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
16.下列说法中正确的是( )
| A. | 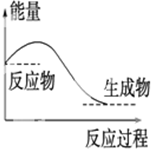 对于如图所示的过程,是放出能量的过程 | |
| B. | 由“C(石墨)=C(金刚石)”反应为吸热,可知,金刚石比石墨稳定 | |
| C. | 由水变成冰是放热反应 | |
| D. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
17. 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )| A. | 既可以催化加氢,又可以使酸性高锰酸钾溶液褪色 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 | |
| C. | 1mol该化合物最多可以与7molNaOH反应 | |
| D. | 可以与Br2的CCl4溶液发生加成反应,但不可以在光照下与Br2发生取代反应 |
14. 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)①④.
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程: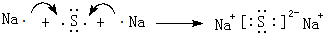 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感.YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得.请写出反应的离子方程式:2ClO3-+SO32-+2H+=2ClO2+SO42-+H2O.
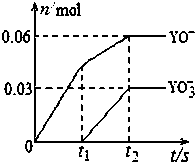
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中
有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是16.8g,该反应中转移电子的物质的量是0.21mol.
 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色. |
| D | 最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)①④.
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程:
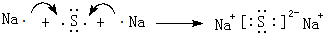 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感.YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得.请写出反应的离子方程式:2ClO3-+SO32-+2H+=2ClO2+SO42-+H2O.
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中
有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是16.8g,该反应中转移电子的物质的量是0.21mol.
1.下列判断正确的是( )
①任何物质在水中都有一定的溶解度
②浊液用过滤的方法分离
③分散系一定是混合物
④丁达尔效应、布朗运动、渗析都是胶体的物理性质
⑤同一种溶质的饱和溶液要比不饱和溶液浓些
⑥布朗运动不是胶体所特有的运动方式
⑦任何溶胶加入可溶性电解质后都能使胶粒发生聚沉
⑧相同条件下,相同溶质的溶液,饱和溶液要比不饱和溶液浓些.
①任何物质在水中都有一定的溶解度
②浊液用过滤的方法分离
③分散系一定是混合物
④丁达尔效应、布朗运动、渗析都是胶体的物理性质
⑤同一种溶质的饱和溶液要比不饱和溶液浓些
⑥布朗运动不是胶体所特有的运动方式
⑦任何溶胶加入可溶性电解质后都能使胶粒发生聚沉
⑧相同条件下,相同溶质的溶液,饱和溶液要比不饱和溶液浓些.
| A. | ③⑥⑧ | B. | ②④⑥⑧⑦ | C. | ①②③④⑤ | D. | 全部不正确 |
11.下列四种烃的名称所表示的物质,命名正确的是( )
| A. | 2-甲基-2-丁烯 | B. | 2-乙基丙烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 2,2-二甲基-3-戊炔 |
18.具有以下结构的原子,一定属于主族元素的是( )
| A. | 最外层有3个未成对电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 次外层无未成对电子的原子 | D. | 最外层有8个电子的原子 |
 如图所示装置:
如图所示装置: