题目内容
10.天然气的主要成分是甲烷,甲烷开发利用的前景非常广阔.(1)已知利用甲烷可催化还原雾霾的形成的元凶NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(2)CO2可转化为甲醇:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
①在一恒温恒容密闭容器中充入1mol CO2和3 mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:0~10min内,氢气的平均反应速率为0.225mol/(L•min).
②若反应在容积可变的容器中进行.缩小容器体积使压强增大,平衡向正反应方向移动(填“正”或“逆”),平衡常数K值不变(填“增大”、“减小”或“不变”).
(3)图2是一个以甲烷燃料电池为电源的电化学示意图,回答下列问题:
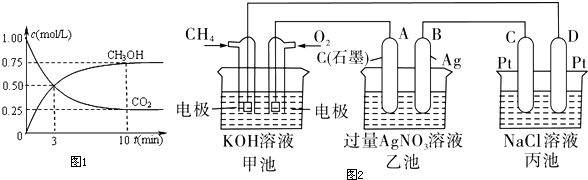
①甲装置中通入CH4 的电极反应式为CH4+10OH--8e-=CO32-+7H2O,
②乙装置中总反应的离子方程式为4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+,
③一段时间,当丙池中D电极产生56mLH2(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=12.(已知:NaCl溶液足量,电解后溶液体积为500mL且假设两极产生的气体全部逸出).
(4)已知甲池反应反应进行到一定程度后可获得K2CO3溶液.
①用离子方程式解释溶液呈现酸碱性的原因:CO32-+H2O?HCO3-+OH-.
②若将等浓度的K2CO3 和KHCO3溶液等体积混合,则离子浓度由大到小的顺序为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温常压下,若将CO2溶于水,达到平衡时.溶液的pH=5.60,c(H2CO3)=1.5×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3的电离平衡常数K1=4.2×10-7(已知:10-5.6=2.5×10-6).
分析 (1)依据热化学方程式和盖斯定律计算得到;
(2)①先根据图表,利用v=$\frac{△c}{△t}$计算v(CO2),再利用各物质的反应速率之比等于计量数之比,确定v(H2);
②缩小容器体积使压强增大,平衡向气体体积减小的方向移动;平衡常数K仅与温度有关;
(3)①甲池为甲烷形成的燃料电池,CH4在负极上失电子,碱性条件下生成碳酸根;
②乙装置中B(Ag)的电极为阴极为阳离子得电子,A电极为阳极为阴离子失电子发生氧化反应,据此书写总反应;
③电解氯化钠溶液时,阴极上氢离子放电,阳极上氯离子放电,根据氯气和氢氧化钠的关系式计算氢氧化钠的物质的量浓度,从而得出溶液的pH;
(4)①K2CO3溶液发生水解反应溶液呈碱性;
②若将等浓度的K2CO3 和KHCO3溶液等体积混合,CO32-水解大于HCO3-离子的水解,溶液呈碱性,以此判断离子浓度大小;
③根据平衡常数K=$\frac{c(HCO{\;}_{3}{\;}^{-})c(H{\;}^{+})}{c(H{\;}_{2}CO{\;}_{3})}$计算.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律(①+②)×$\frac{1}{2}$得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)①由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L•min)=0.225mol/(L•min),故答案为:0.225mol/(L•min);
②缩小容器体积使压强增大,平衡向气体体积减小的方向即正反应方向移动;因为平衡常数K仅与温度有关,所以温度没变,K不变,故答案为:正;不变;
(3)①甲池中一极通入甲烷,另一极通入氧气,所以甲池为甲烷形成的燃料电池,通入甲烷的一极为负极,碱性条件下生成碳酸根,所以甲装置中通入CH4的电极反应式为CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
②乙装置中B(Ag)的电极为阴极为阳离子得电子,A电极为阳极为阴离子失电子发生氧化反应,总反应为电解硝酸银溶液,离子方程式为:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+;故答案为:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+;
(3)设电解后氢氧化钠的物质的量浓度是xmol/L,丙池中产生112mL,则氢气的体积与氯气的体积相同均为56ml,
2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,
22.4L 2mol
0.056L 0.5xmol
则x=$\frac{2mol×0.056L}{22.4L×0.5mol}$=0.01mol/L
则C(H+)=10-12 mol/L,所以溶液的pH=12,
故答案为:12;
(4)①K2CO3溶液发生水解反应溶液呈碱性,方程式为:CO32-+H2O?HCO3-+OH-;故答案为:CO32-+H2O?HCO3-+OH-;
②若将等浓度的K2CO3 和KHCO3溶液等体积混合,CO32-水解大于HCO3-离子的水解,溶液呈碱性,则
c(OH-)>c(H+),两种盐水解程度较小,则c(CO32-)>c(OH-),故为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③根据平衡常数K=$\frac{c(HCO{\;}_{3}{\;}^{-})c(H{\;}^{+})}{c(H{\;}_{2}CO{\;}_{3})}$=$\frac{10{\;}^{-5.6}×10{\;}^{-5.6}}{1.5×10{\;}^{-5}}$=4.2×10-7,故答案为:4.2×10-7.
点评 本题考查较为全面,涉及热化学方程式的计算、电化学知识等知识,为高考高频考点,掌握反应热计算的方法、电化学原理尤为重要,题目难度中等.

| A. | ①②③④ | B. | ②③④ | C. | ①③ | D. | ②④ |
①任何物质在水中都有一定的溶解度
②浊液用过滤的方法分离
③分散系一定是混合物
④丁达尔效应、布朗运动、渗析都是胶体的物理性质
⑤同一种溶质的饱和溶液要比不饱和溶液浓些
⑥布朗运动不是胶体所特有的运动方式
⑦任何溶胶加入可溶性电解质后都能使胶粒发生聚沉
⑧相同条件下,相同溶质的溶液,饱和溶液要比不饱和溶液浓些.
| A. | ③⑥⑧ | B. | ②④⑥⑧⑦ | C. | ①②③④⑤ | D. | 全部不正确 |
| A. | 最外层有3个未成对电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 次外层无未成对电子的原子 | D. | 最外层有8个电子的原子 |
| A. | ClO -水解平衡常数表达式为Kh=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$ | |
| B. | NH3•H2O的电离平衡常数表达式为Kb=$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | |
| C. | PbI2溶度积常数表达式为Ksp=c(Pb2+)•c2(I-) | |
| D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$ |
| A. | 该反应为吸热反应 | |
| B. | CO2分子是由极性键形成的极性分子 | |
| C. | HCHO分子中既含σ键又含π键 | |
| D. | 每生成1.8gH2O消耗2.24L O2 |