题目内容
16.工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品.(1)将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为77.78%,若所得硝酸密度为ρg/cm3,则其物质的量浓度为12.35ρmol/L(保留两位小数).
(2)某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为47435.29 m3(保留两位小数).
(3)一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体.测出混合气体密度是同温同压下氢气的28倍.再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定).计算混合气体中NO2的体积分数.
(4)合成氨原料气由CH4在高温下与水蒸气、空气反应而得.反应原理如下:CH4+2H2O→CO2+4H2 2CH4+O2+2H2O→2CO2+6H2.将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2.为使进入合成氨反应塔两者体积比为1:3.计算起始气体中CH4和空气的比例.(已知空气中O2和N2的体积比为1:4).
分析 (1)由方程式4NH3+5O2═4NO+6H2O,4NO+3O2+2H2O═4HNO3分析解答;根据公式C=$\frac{1000ρw}{M}$来分析求解;
(2)根据方程式和关系式来计算氨气的物质的量,然后根据公式V=nVm来求解;
(3)对氢气的相对密度为28的混合气体,平均分子量为56,浓硝酸与足量的铜反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,NO2分子量为46,NO分子量为30,所以,此时存在2NO2?N2O4,即混合气体是:NO2、N2O4、NO,设生成1mol混合气体,三者的物质的量分别为xmol、ymol、zmol,根据物质的量以及平均摩尔质量列式,结合气体通过水后,体积缩小了$\frac{1}{3}$计算xmol、ymol、zmol.相同条件下,体积百分含量等于物质的量分数;
(4)N2和H2进入合成氨反应塔两者体积比为1:3,可以设氮气的体积为4x,而氢气的体积为12x,则氧气的体积为x,根据方程式2CH4+O2+2H2O→2CO2+6H2,x体积的氧气生成6x体积的氢气,消耗2x体积的CH4,另外6x体积的氢气由CH4+2H2O→CO2+4H2,消耗CH4为:$\frac{3}{2}$体积,由此分析解答.
解答 解:(1)设氨气的物质的量为4xmol,则硝酸溶液中溶质的质量分数为:$\frac{4x×63}{4x×63+(6x-2x)×18}$=77.78%,C=$\frac{1000ρw}{M}$=$\frac{1000×ρ×0.778}{63}$=12.35ρmol/L,故答案为:77.78%;12.35ρmol/L;
(2)根据合成 NH4NO3 的反应:NH3+HNO3=NH4NO3,合成80tNH4NO3时,需要用63tHNO3 吸收17t的 NH3,设制备 63tHNO3 需要m(NH3)
NH3~~~~~~~~~~~~~~~HNO3
17 63
m(NH3)×96%×92% 63 t
$\frac{17}{m(N{H}_{3})×96%×92%\\;}=\frac{63}{63t}$
解之得:m(NH3)=19 t,所以V(NH3)=$\frac{(17+19)×1{0}^{6}}{17}×22.4×1{0}^{-3}$=47435.29(m3),故答案为:47435.29(m3);
(3)浓硝酸与足量的铜反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,反应生成的气体NO2分子量为46,NO分子量为30,得到对氢气的相对密度为28的混合气体,平均分子量为56,说明此时存在2NO2?N2O4,即混合气体是:NO2、N2O4、NO,设生成1mol混合气体,三者的物质的量分别为xmol、ymol、zmol,x+y+z=1mol①,平均相对分子质量为56,得46x+92y+30z=56②,气体通过水后,体积缩小了$\frac{1}{3}$,即最后气体体积为$\frac{2}{3}$,N2O4相当于2个NO2,3NO2+H2O=2HNO3+NO,相当于NO2和N2O4与水反应生成NO,3个NO2生成1个NO,即:,$\frac{(x+2y)}{3}+z=\frac{2}{3}$③,联①②③解得:x=y=z=$\frac{1}{3}$mol,则混合气体中含NO2的体积百分含量为$\frac{1}{3}$≈33.3%,答:混合气体中NO2的体积分数为33.3%;
(4)N2和H2进入合成氨反应塔两者体积比为1:3,可以设氮气的体积为4x,而氢气的体积为12x,则氧气的体积为x,根据方程式2CH4+O2+2H2O→2CO2+6H2,x体积的氧气生成6x体积的氢气,消耗2x体积的CH4,另外6x体积的氢气由CH4+2H2O→CO2+4H2,消耗CH4为:$\frac{3}{2}$x体积,起始气体中CH4和空气的比例为:(2x+$\frac{3}{2}$x):5x=7:10,答:起始气体中CH4和空气的比例为7:10.
点评 本题考查氮的化合物的计算,为高频考点,注意隐含条件2NO2?N2O4为解答的关键,侧重考查学生的分析思维能力与解题方法技巧,题目难度中等.

| A. | 土壤中离子的吸附和交换过程,有保肥作用 | |
| B. | 由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| C. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
| A. | R原子的电子数为10+n | B. | R能形成Rn-离子 | ||
| C. | R的最高氧化物为R2On或ROn/2 | D. | R的气态氢化物的化学式是H8-nR |
| A. | 沸点:H2O>H2Se>H2S | B. | 酸性:H2SO4>H2CO3>HClO | ||
| C. | 硬度:I2>Br2>Cl2 | D. | 碱性:KOH>NaOH>Al(OH)3 |
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 在试管中滴入适量C2H5X与NaOH溶液,振荡、加热、静置分层后,取水层加稀硝酸酸化,再滴加数滴AgNO3溶液 | 淡黄色沉淀 | 证明卤代烃中含有溴元素 |
| B | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| C | 在大试管中依次加入适量丁醇、过量乙酸、几滴浓硫酸,混合后塞上带长导管的试管塞,放在石棉网上方空气中加热至120℃左右 | 反应液沸腾,冷却静置,上层油状透明液体有水果香味 | 该油状液体为乙酸丁酯 |
| D | 在简易启普发生器中向石灰石中加入浓醋酸,将产生的气体直接通入苯酚钠溶液中 | 苯酚钠溶液产生浑浊 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 第6min后,生成A的平均速率为0mol/(L•min) | |
| B. | A的平衡转化率为85% | |
| C. | 升高温度时,生成A的平均速率大于消耗A的平均速率 | |
| D. | 降低温度时,生成A的平均速率和消耗A的平均速率以不同倍数减少 |
| A. | Na、Mg、Al原子的失电子能力依次增强 | |
| B. | Li、Na、K的最高价氧化物对应的水化物的碱性依次减弱 | |
| C. | Si、P、S元素的气态氢化物的稳定性依次降低 | |
| D. | C、N、O的原子半径依次减小 |
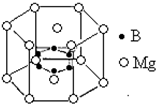 2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内.
2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内. .
.