题目内容
9.下列有关NaClO和NaCl混合溶液的叙述正确的是( )| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H20 | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
分析 A、次氯酸为弱酸,次氯酸根与氢离子不能大量共存;
B、银离子与氯离子生成AgCl白色难溶沉淀,故而不能电离共存;
C、NaClO为强碱弱酸盐,水解呈碱性,NaCl为中性,溶液中不存在大量的氢离子;
D、次氯酸具有氧化性,浓盐酸具有还原性,两者发生归中反应生成氯气,据此解答即可.
解答 解:A、NaClO和NaCl混合溶液中存在大量的次氯酸根,次氯酸为弱酸,次氯酸根与氢离子不能大量共存,故A错误;
B、NaClO和NaCl混合溶液中存在大量的氯离子,与银离子反应生成白色难溶沉淀,故不能大量共存,故B错误;
C、NaClO为强碱弱酸盐,水解呈碱性,NaCl为中性,溶液中不存在大量的氢离子,与2Fe2++ClO-+2H+═Cl-+2Fe3++H20反应矛盾,故C错误;
D、浓盐酸中Cl由-1价升高到0价,次氯酸中Cl由+1价降低到0价,故每生成1mol氯气转移电子数为1mol,故D正确,故选D.
点评 本题主要考查的是溶液中离子的判断,涉及离子共存、盐类水解、氧化还原反应原理等,综合性较强,容易出错的是C选项,没有注意原溶液的酸碱性.

练习册系列答案
相关题目
19.将 0.06mol•L-1H2SO4溶液与0.10mol•L-1NaOH 溶液等体积混合后,所得溶液的pH 为( )
| A. | 1.7 | B. | 2.0 | C. | 12.0 | D. | 12.3 |
20.常温下,下列说法正确的是( )
| A. | 0.1mol•L-1 的硫酸溶液中NH4+、Fe2+、Cl-、NO3-可以共存 | |
| B. | 向Ba(OH)2 溶液中滴入硫酸溶液的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| C. | 0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,所有离子浓度均增大 | |
| D. | pH=11的NaOH 溶液中有:[OH-]=[Na+]+[H+] |
14.某研究小组将纯净的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图.
实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2H2O+2NO3-=2NO+4H++3SO42-.
(3)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论.
(4)若假设二成立,请预测:在相同条件下,分别用足量的O2和KNO3氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者小于(填“大于”或“小于”)后者,理由是反应的离子方程式表明,足量的O2和NO3-分别氧化相同的H2SO3,生成的H+的物质的量前者大于后者.
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 生成白色沉淀 |

实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2H2O+2NO3-=2NO+4H++3SO42-.
(3)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论.
| 实验步骤、预期现象和结论(不要求写具体操作过程): |
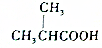 的官能团为-COOH;在0.1mol/L该酸的水溶液中就1滴酚酞试液,溶液呈无色.
的官能团为-COOH;在0.1mol/L该酸的水溶液中就1滴酚酞试液,溶液呈无色.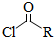 )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ: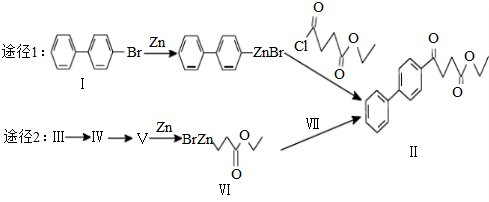
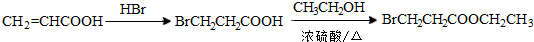 .(标明反应试剂,忽略反应条件).
.(标明反应试剂,忽略反应条件).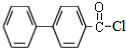 .
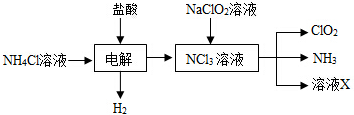
.

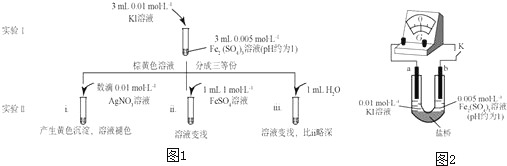
 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.