题目内容
14.某研究小组将纯净的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 生成白色沉淀 |

实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2H2O+2NO3-=2NO+4H++3SO42-.
(3)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论.
| 实验步骤、预期现象和结论(不要求写具体操作过程): |
分析 (1)根据强酸制取弱酸的原理,亚硫酸是弱酸不能制备盐酸,故实验1无现象;二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子:H2SO3?2H++SO32-,H+、NO3-结合生成具有强氧化性的HNO3,硝酸将亚硫酸根离子氧化成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡;
(2)试验1中,二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子,所以溶液的pH减小;试验2中反应生成强电解质硫酸,则实验2的pH更小;
(3)验证假设二,需要用实验1做对比实验,然后做实验3:在盛有未经脱O2处理的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体,若有白色沉淀生成,则假设二成立;
(4)氧气与亚硫酸反应的离子方程式为:2H2SO3+O2=4H++2SO42-,亚硫酸与硝酸根离子反应的离子方程式为:3H2SO3+2NO3-=2NO↑+4H++H2O+3SO42-,根据反应方程式判断两溶液的pH大小.
解答 解:(1)根据强酸制取弱酸的原理,亚硫酸是弱酸不能制备盐酸,故实验1无现象;
二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子:H2SO3?2H++SO32-,H+、NO3-结合生成具有强氧化性的HNO3,硝酸将亚硫酸根离子氧化成硫酸根离子,从而生成硫酸钡沉淀,
故答案为:无现象;白色沉淀生成;
(2)试验1中,二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子:H2SO3?2H++SO32-,所以溶液的pH减小;试验2发生反应:3SO2+2H2O+2NO3-=2NO+4H++3SO42-,反应中生成了强酸硫酸,则实验2的pH小于实验1,
故答案为:SO2溶于水后生成H2SO3,亚硫酸显酸性,故pH值减小;3SO2+2H2O+2NO3-=2NO+4H++3SO42-;
(3)验证假设二,需要用实验1做对比实验,然后做实验3:在盛有未经脱O2处理的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体,若有白色沉淀生成,则假设二成立,即:
实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设二成立 |
| 实验3:在盛有未经脱O2处理的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 有白色沉淀生成 |
故答案为:
实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设二成立 |
| 实验3:在盛有未经脱O2处理的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 有白色沉淀生成 |
故答案为:小于;反应的离子方程式表明,足量的O2和NO3-分步氧化相同的亚硫酸,生成的氢离子的物质的量前者大于后者.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验目的及实验原理为解答关键,试题充分考查学生的分析、理解能力及化学实验能力,注意掌握物质性质实验方案的设计与评价原则.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H20 | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
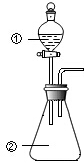 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2s22p3和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p3 | D. | 3s23p1和3s23p4 |
 .
.