题目内容
17.物质的量浓度相同(0.1mol•L-1)的弱酸HX与NaX溶液等体积混合后,溶液中粒子浓度关系错误的是( )| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| C. | c(HX)+c(X-)=2c(Na+) | |
| D. | 若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
分析 A.利用电荷守恒分析,阳离子所带正电荷总数等于阴离子所带负电荷总数;
B.利用物物料守恒分析X元素存在形式不同,但X物质的量不变;
C.物质的量浓度相同(0.1mol•L-1)的弱酸HX与NaX溶液等体积混合后,溶液显酸性,则c(H+)>c(OH-),电离大于水解;
D.溶液为碱性,则水解大于电离.
解答 解:A.由电荷守恒可知,c(Na+)+c(H+)=c(X-)+c(OH-),故A正确;
B.物质的量浓度相同(0.1mol•L-1)的弱酸HX与NaX溶液等体积混合后,溶液显酸性,则c(H+)>c(OH-),电离大于水解,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故B正确;
C.由物物料守恒可知,n(X)=2n(Na),则c(HX)+c(X-)=2c(Na+),故C正确;
D.溶液为碱性,则水解大于电离,则c(HX)>c(Na+)>c(X-)>c(OH-)>c(H+),故D错误;
故选D.
点评 本题考查离子浓度的大小比较,题目难度中等,注意离子浓度大小比较要考虑电解质的电离、盐类水解、水的电离、电荷守恒、物料守恒、质子恒等式,注意体会理解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3(g),能说明该反应达到化学平衡状态的是( )
| A. | 生成NH3的物质的量与消耗NH3的物质的量相等 | |
| B. | 消耗1molN2,同时消耗3molH2 | |
| C. | N2、H2、NH3在密闭容器中共存 | |
| D. | 正、逆反应速率都等于0 |
8.下列化学用语正确的组合是( )
①氚:${\;}_{1}^{3}$H ②S2-: ③Na2O2:
③Na2O2:
④ ⑤
⑤ ⑥N2
⑥N2
①氚:${\;}_{1}^{3}$H ②S2-:
 ③Na2O2:
③Na2O2:
④
 ⑤
⑤ ⑥N2
⑥N2
| A. | ①③⑤⑥ | B. | ①③④⑤ | C. | ①⑤⑥ | D. | ②⑤⑥ |
5.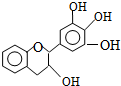 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 遇FeCl3溶液发生显色反应且能发生水解反应 |
12.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.15mol/(L•min),②v(B)=0.01mol/(L•s),③v(C)=0.40mol/(L•min),④v(D)=0.45mol/(L•min),该反应进行的快慢情况下列说法正确的是( )
| A. | ④>③>②>① | B. | ④>③>①>② | C. | ②>④=③>① | D. | ④>③=②>① |
9.下列溶液中氯离子浓度与20mL 1mol•L-1氯化铝溶液中的氯离子浓度相等的是( )
| A. | 60 mL 1 mol•L-1的氯化钠溶液 | B. | 30 mL 2 mol•L-1的氯化铵溶液 | ||
| C. | 60 mL 3 mol•L-1的氯化钾溶液 | D. | 30 mL 1 mol•L-1的氯化铁溶液 |
7.下列离子方程式书写正确的是( )
| A. | 金属钠投入到水中 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液与盐酸反应:HCO3-+H+═CO2↑+H2 O | |
| C. | 强酸与强碱反应:H++OH-═H2O | |
| D. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O |