题目内容
8.下列化学用语正确的组合是( )①氚:${\;}_{1}^{3}$H ②S2-:
 ③Na2O2:
③Na2O2:
④
 ⑤
⑤ ⑥N2
⑥N2
| A. | ①③⑤⑥ | B. | ①③④⑤ | C. | ①⑤⑥ | D. | ②⑤⑥ |
分析 ①氚的质子数为1、质量数为3;
②S2-的核电荷数为16,核外电子总数为18,最外层为8个电子;
③过氧化钠为离子化合物,阴阳离子需要标出所带电荷,过氧根离子还需要标出最外层电子;
④该形成过程中左边氯原子错误;
⑤氨气分子中含有3个氮氢键,用短线代替所有共用电子对即为结构式;
⑥氮气分子中含有氮氮三键,氮原子最外层达到8电子稳定结构.
解答 解:①氚的质子数为1、质量数为3,该核素可以表示为:${\;}_{1}^{3}$H,故①正确;
②S2-的核电荷数为16,最外层达到8电子稳定结构,硫离子正确的离子结构示意图为: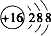 ,故②错误;
,故②错误;
③Na2O2为离子化合物,化学式中存在1个过氧根离子和2个钠离子,过氧化钠的电子式为: ,故③正确;
,故③正确;
④氯化钙为离子化合物,用电子式表示下列物质的形成过程为: ,故④错误;
,故④错误;
⑤氨气为共价化合物,分子中存在3个氮氢键,氨气的结构简式为: ,故⑤正确;
,故⑤正确;
⑥氮气分子中含有氮氮三键,氮气的电子式为: ,故⑥正确;
,故⑥正确;
根据分析可知,正确的为:①③⑤⑥,
故选A.
点评 本题考查了电子式、结构式、离子结构示意图、元素符号等化学用语的表示方法,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确离子结构示意图与原子结构示意图的区别,试题培养了学生规范答题的能力.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
18.有四种物质:①NaHCO3、②Al(OH)3、③(NH4)2CO3、④NH2-CH2-COOH,其中既能跟盐酸,又能跟NaOH溶液反应的有( )
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
19.当CH3COOH?CH3COO-+H+已达平衡,若要使醋酸的电离平衡向左移动和溶液的pH值都减小,应加入的试剂是( )
| A. | CH3COONa | B. | NH3•H2O | C. | HCl | D. | H2O |
16.某链状有机物分子中含m个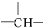 ,n个-C2H5,a个
,n个-C2H5,a个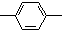 ,其余为氯原子,则氯原子的数目可能是( )
,其余为氯原子,则氯原子的数目可能是( )
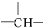 ,n个-C2H5,a个
,n个-C2H5,a个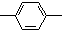 ,其余为氯原子,则氯原子的数目可能是( )
,其余为氯原子,则氯原子的数目可能是( )| A. | m+2-n | B. | n+2a-3m | C. | n+m+a | D. | a+n+2-2m |
13.下列实验中,反应速率加快是由催化剂引起的是( )
| A. | 在炭粉中加入KClO3,点燃时燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快 | |
| C. | 双氧水中加入少量FeCl3,可加快放出气体的速率 | |
| D. | 固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 |
20.针对如图所示乙醇分子结构,下述关于乙醇在各种反应中化学键断裂情况的说法不正确的是( )
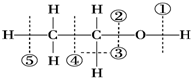

| A. | 与醋酸、浓硫酸共热时,②键断裂 | B. | 与金属钠反应时,①键断裂 | ||
| C. | 与浓硫酸共热至170℃时,②⑤键断裂 | D. | 在银催化下与O2反应时,①③键断裂 |
17.物质的量浓度相同(0.1mol•L-1)的弱酸HX与NaX溶液等体积混合后,溶液中粒子浓度关系错误的是( )
| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| C. | c(HX)+c(X-)=2c(Na+) | |
| D. | 若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
18.某同学按下列步骤配制500mL 0.2mol•L-1Na2SO4溶液,请回答有关问题.
(1)上述实验中使用容量瓶前应检查容量瓶是否漏液.
(2)取出该Na2SO4溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是0.04mol/L.
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需重新配制.
(4)配制Na2SO4溶液时,下列操作情况会使结果偏高的是C.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
| 实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为14.2克 |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平和药匙 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒搅拌 |
| ④将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: 转移过程中用玻棒进行引流 |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: 改用胶头滴管加水至凹液面与刻度线相切 |
(2)取出该Na2SO4溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是0.04mol/L.
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需重新配制.
(4)配制Na2SO4溶液时,下列操作情况会使结果偏高的是C.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
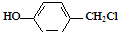 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 ;
; ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 ;
; .
.