题目内容
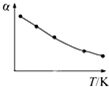
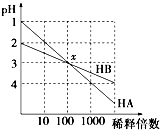 HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )
HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )| A、HA是一种强酸 |
| B、x点,[A-]=[B-] |
| C、HB是一种弱酸 |
| D、原溶液中HA的物质的量浓度为HB的10倍 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:弱电解质中存在电离平衡,加水稀释促进弱酸电离,HA稀释1000倍时,溶液pH由1变为4,说明HA是强电解质,为强酸;HB稀释100倍时,溶液pH由2变为3,如果是强酸,则pH应该变为4,所以HB是弱酸,再结合题目分析解答.
解答:
解:弱电解质中存在电离平衡,加水稀释促进弱酸电离,HA稀释1000倍时,溶液pH由1变为4,说明HA是强电解质,为强酸;HB稀释100倍时,溶液pH由2变为3,如果是强酸,则pH应该变为4,所以HB是弱酸,
A.通过以上分析知,HA是强酸,故A正确;
B.x点,溶液的pH相等,说明溶液中氢离子浓度相等,根据离子积常数知,氢氧根离子浓度相等,再结合电荷守恒知[A-]=[B-],故B正确;
C.通过以上分析知,HB是弱酸,故C正确;
D.HA是强酸、HB是弱酸,所以HB中氢离子浓度小于酸浓度,则原溶液中HA的物质的量浓度小于HB的10倍,故D错误;
故选D.
A.通过以上分析知,HA是强酸,故A正确;
B.x点,溶液的pH相等,说明溶液中氢离子浓度相等,根据离子积常数知,氢氧根离子浓度相等,再结合电荷守恒知[A-]=[B-],故B正确;
C.通过以上分析知,HB是弱酸,故C正确;
D.HA是强酸、HB是弱酸,所以HB中氢离子浓度小于酸浓度,则原溶液中HA的物质的量浓度小于HB的10倍,故D错误;
故选D.
点评:本题考查了弱电解质的电离,根据溶液纵横坐标的变化确定酸的强弱,再结合电荷守恒解答,题目难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
下列有关化学用语表示正确的是( )
A、N2的电子式: |
| B、质子数为53、中子数为78的碘原子:131I |
| C、HClO的结构简式:H-Cl-O |
D、S2-的结构示意图: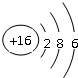 |
在下列五种物质的组合中,既能跟氢氧化钠溶液反应,又能跟盐酸反应,且在生成物中都有盐和水的是( )
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3 ⑥FeO.
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3 ⑥FeO.
| A、①②③ | B、①③⑤ |
| C、②③⑤ | D、②④⑤⑥ |
下列对Na2O2的叙述中,正确的是( )
| A、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
| B、Na2O2中氧元素的化合价为-2价 |
| C、Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2 |
| D、Na2O2需要密封保存 |
下列变化过程中,△S<0的是( )
| A、干冰升华 |
| B、CaCO3(s)分解为CaO(s)和CO2(g) |
| C、NH3(g)与HCl(g)反应生成NH4Cl(s) |
| D、氯化钠溶于水中 |

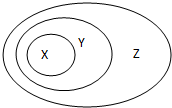 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )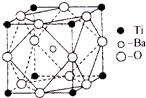 在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是
在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是