题目内容
可逆反应3A(g)?3B(?)+C(?)△H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空.
①若B、C都是气体,气体的平均相对分子质量 .
②若B、C都不是气体,气体的平均相对分子质量 .
③若B是气体,C不是气体,气体的平均相对分子质量 .
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是 态,C是 态.
(3)如果B为气体,C为固体,取3mol A恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol?L-1.若使反应从逆反应开始,起始时在容器中加入3mol B,同样条件下,要使平衡时B的浓度仍为2.1mol?L-1,则C的物质的量的取值范围应该是 .
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空.
①若B、C都是气体,气体的平均相对分子质量
②若B、C都不是气体,气体的平均相对分子质量
③若B是气体,C不是气体,气体的平均相对分子质量
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是
(3)如果B为气体,C为固体,取3mol A恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol?L-1.若使反应从逆反应开始,起始时在容器中加入3mol B,同样条件下,要使平衡时B的浓度仍为2.1mol?L-1,则C的物质的量的取值范围应该是
考点:化学平衡的影响因素
专题:化学反应中的能量变化
分析:(1)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则说明平衡向正反应移动,反应物气体的计量数大于生成物气体的计量数;
(3)依据化学平衡极值转化分析C所需要的取值范围;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则说明平衡向正反应移动,反应物气体的计量数大于生成物气体的计量数;
(3)依据化学平衡极值转化分析C所需要的取值范围;
解答:
解:(1)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
①.若B、C都是气体,气体的总质量不变,但物质的量增大,则气体的平均相对分子质量变小,故答案为:变小;
②.若B、C都不是气体,气体只有A,则气体的平均相对分子质量不变,故答案为:不变;
③.若B是气体,C不是气体,气体的物质的量不变,但气体的质量减小,则相对分子质量减小,故答案为:变小;
(2)如果平衡后保持温度不变,将容器体积增加一倍,如平衡不移动,则新平衡时A的浓度是原来的50%,而新平衡时A的浓度是原来的60%,说明平衡向正反应移动,反应物气体的计量数大于生成物气体的计量数,所以B为固体或液体,C为气体,故答案为:固或液;气;
(3)如果B为气体,C为固体,反应为3A(g)=3B(g)+C(s)△H>0,取3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L,此时应生成C的物质的量为0.7mol,若使反应从逆反应开始,起始时在容器中加入3molB,同样条件下,要使平衡时B的浓度仍为2.1mol/L,需要反应B物质的量为0.9mol,最少需要C物质的量大于0.3mol,在平衡体系中,增加固体组分的用量,不会使平衡发生移动,则C的取值为n(C)>0.3;
故答案为:n(C)>0.3.
①.若B、C都是气体,气体的总质量不变,但物质的量增大,则气体的平均相对分子质量变小,故答案为:变小;
②.若B、C都不是气体,气体只有A,则气体的平均相对分子质量不变,故答案为:不变;
③.若B是气体,C不是气体,气体的物质的量不变,但气体的质量减小,则相对分子质量减小,故答案为:变小;
(2)如果平衡后保持温度不变,将容器体积增加一倍,如平衡不移动,则新平衡时A的浓度是原来的50%,而新平衡时A的浓度是原来的60%,说明平衡向正反应移动,反应物气体的计量数大于生成物气体的计量数,所以B为固体或液体,C为气体,故答案为:固或液;气;
(3)如果B为气体,C为固体,反应为3A(g)=3B(g)+C(s)△H>0,取3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L,此时应生成C的物质的量为0.7mol,若使反应从逆反应开始,起始时在容器中加入3molB,同样条件下,要使平衡时B的浓度仍为2.1mol/L,需要反应B物质的量为0.9mol,最少需要C物质的量大于0.3mol,在平衡体系中,增加固体组分的用量,不会使平衡发生移动,则C的取值为n(C)>0.3;
故答案为:n(C)>0.3.
点评:本题考查化学平衡的移动,侧重于基础知识的考查,为高考高频考点,注意把握相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g)?2CO2(g)+S(l)△H<0
一定温度下,在容积为2L的恒容密闭容器中充入1mol SO2和n mol CO发生反应,5min后达到平衡,生成2a mol CO2.下列说法正确的是( )
一定温度下,在容积为2L的恒容密闭容器中充入1mol SO2和n mol CO发生反应,5min后达到平衡,生成2a mol CO2.下列说法正确的是( )
| A、平衡后保持其它条件不变,从容器中分离出部分硫,平衡向正反应方向移动 |
| B、当混合气体的物质的量不再改变时,反应达到平衡状态 |
| C、平衡后保持其它条件不变,升高温度和加入催化剂,SO2的转化率均增大 |
| D、反应前2min的平均速率v(SO2)=0.1a mol/(L?min) |
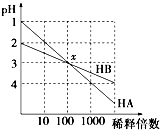 HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )
HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )| A、HA是一种强酸 |
| B、x点,[A-]=[B-] |
| C、HB是一种弱酸 |
| D、原溶液中HA的物质的量浓度为HB的10倍 |
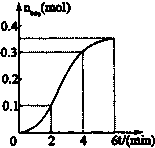 已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A、反应开始后2~4分钟内平均反应速率最大 |
| B、反应刚开始时反应速率较小,然后逐渐增大 |
| C、反应前阶段速率逐渐增大,是因为反应放热,使反应速率加快 |
| D、生成物CaCl2、CO2和H2O的总能量比反应物CaCO3和盐酸的总能量高 |
下列化学用语中表述正确的是( )
A、甲醛的电子式: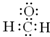 |
| B、二氧化硅的分子式SiO2 |
C、丙烷的分子球棍模型示意图: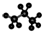 |
D、818O2-离子结构示意图: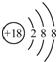 |

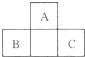 如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则: