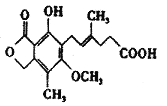
题目内容
【题目】25℃时,pH=2的HA和HB各1 mL分别加水稀释,pH随溶液体积变化如图所示。下列叙述正确的是

A. Kw的数值:a点大于c点
B. 溶液中的总酸量:a点大于b点
C. HB的电离程度:b点大于c点
D. 将a点与b点两溶液同时升高温度,则![]() 减小
减小
【答案】D
【解析】两种酸开始pH=2,稀释103倍后HA pH=5,而HB pH<5,所以HA为强酸,HB为弱酸。A项,25℃时,KW=10-14是一个常数,故A错误;B项,两种酸开始pH=2,HB为弱酸,所以溶液中的总酸量a点小于b点,故B错误;C项,稀释促进电离,HB的电离程度:c点大于b点,故C错误;D项,将a点与b点两溶液同时升高温度,因为HA是强酸,所以c(A-)不变,HB为弱酸,升高温度促进电离,c(B-)增大,所以![]() 减小,故D正确。综上,选D。
减小,故D正确。综上,选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 浓盐酸 | MnO2 | 产生黄绿色气体 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 酸化的FeCl2溶液 | H2O2溶液 | 溶液变成棕黄色,有气泡产生 |
D | Fe2(SO4)3溶液 | 铜粉 | 溶液变蓝色、有黑色固体产生 |

A. A B. B C. C D. D