题目内容
【题目】一种免疫抑制剂麦考酚酸结构简式如图所示,下列有关麦考酚酸说法不正确的是
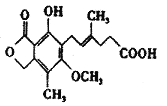
A. 分子式为C17H20O6
B. 能与FeCl3溶液显色,与浓溴水反应,最多消耗1molBr2
C. 1mol麦考酚酸最多与2molNa2CO3反应生成CO2
D. 在一定条件下可发生还原,氧化、加聚、水解反应
【答案】C
【解析】A.由结构可知分子式为C17H20O6,故A正确;B.含酚-OH,能与FeCl3溶液显色,双键与溴水发生加成反应,与浓溴水反应,最多消耗1molBr2,故B正确;C.1mol麦考酚酸含有1mol羧基,最多与0.5molNa2CO3反应生成0.5CO2,故C错误;D.该有机物含有碳碳双键,在一定条件下可发生还原,氧化、加聚反应、含有酯基,能够发生水解反应,故D正确;故选C。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】某学习小组分析实验室制氯气的方法后认为:MnO2与FeCl3·6H2O共热能产生Cl2,于是设计了下列装置验证该结论。
【查阅资料】FeCl3·6H2O是棕黄色晶体,熔点37℃,沸点280~285℃。
【实验设计】

若结论成立,B中发生反应的化学方程式是___,C中的试剂是___。
【实验过程】
操作 | 现象 |
(1)经检查,装置气密性良好。 (2)添加药品,连接装置。 (3)点燃酒精灯。 | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝。 |
【实验分析】
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是___。
(2)分析现象ii时发生了分歧,有同学认为:FeCl3·6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是___。
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3·6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴。
b.____________________________________ ,溶液变红。
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2。饱和氯化钠溶液的主要作用是___。
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是________。从混合物中分离出Fe2O3的方法是:___。
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是___ (填写编号)。
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出


