题目内容
【题目】已知2MOyx-+5S2-+16H+=2M2++5S↓+8H2O,则MOyx-中的M的化合价为
A. +3 B. +4 C. +6 D. +7
【答案】D
【解析】根据元素守恒可以得到y=4,再根据电荷守恒可以得到2x+5ⅹ(-2)+16=4,解得x=-1.
MOyx-的离子符号为MO4-,假设M的化合价位n,可以得到式子n+(-2)ⅹ7=-1,解得n=+7,所以答案选D.

【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2反应得到,化学方程式为
2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH1 K1
NaNO3(s)+ClNO(g) ΔH1 K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2Cl2(g)+2NO(g) ΔH2 K2
2NaNO3(s)+2Cl2(g)+2NO(g) ΔH2 K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH3 K3
2ClNO(g) ΔH3 K3
ΔH1 、ΔH2 、ΔH3 之间的关系式为______;平衡常数K1、K2、K3之间的关系式为_______。
(2)已知几种化学键的键能数据如下:
化学键 | NO中的氮氧键 | Cl-Cl键 | Cl-N键 | ClNO中的N=O键 |
键能/(KJ/mol) | 630 | 243 | a | 607 |
则ΔH3+2a=_________。
(3)300℃时,2ClNO(g)![]() 2NO(g)+Cl2(g)的正反应速率的表达式为v正=k·cn(ClNO)(k为速率常数,只与温度有关),测得塑料厂与浓度关系如下表所示:
2NO(g)+Cl2(g)的正反应速率的表达式为v正=k·cn(ClNO)(k为速率常数,只与温度有关),测得塑料厂与浓度关系如下表所示:
序数 | c(ClNO)/(mol/L) | v/(mol·L·s) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=___________,k=____________。
(4)在两个容积均为2L的恒容密闭容器中分别加入4mol和2mol ClNO,在不同温度下发生反应:2ClNO(g) ![]() 2NO(g)+Cl2(g),达道平衡时ClNO的浓度随温度变化的曲线如图所示(图中ABC点均位于曲线上)。
2NO(g)+Cl2(g),达道平衡时ClNO的浓度随温度变化的曲线如图所示(图中ABC点均位于曲线上)。

①2ClNO(g) ![]() 2NO(g)+Cl2(g) ΔS____0(选填“>”“<”或“=”)。
2NO(g)+Cl2(g) ΔS____0(选填“>”“<”或“=”)。
②A、B两点平衡常数之比为K(A):K(B)=_____。
③B、C两点ClNO的转化率a(B)______a(C) (选填“>”“<”或“=”)。
(5)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g) ΔH=-748KJ/mol
2CO2(g)+N2(g) ΔH=-748KJ/mol
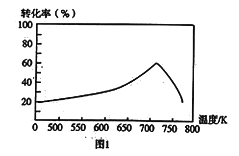
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是___________。
②已知:测定空气中NO和CO含量可用电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______。