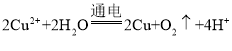题目内容
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验:

(1)先关闭活塞a,将6.4g铜片和10mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:打开活塞a之前______________;打开活塞a之后______________;
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整______________;
(2)实际上,在打开活塞a之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量.他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________(填化学式);
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100mL溶液,再取20mL于锥形瓶中,用______________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为______________;再求出余酸的物质的量,若耗去amol/L氢氧化钠溶液bmL,则原余酸的物质的量为______________mol(用含a、b的表达式来表示)。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 2Cu+2H2SO4+O2=2CuSO4+2H2O
CuSO4+SO2↑+2H2O 2Cu+2H2SO4+O2=2CuSO4+2H2O 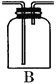 饱和NaHSO3 甲基橙 Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断
饱和NaHSO3 甲基橙 Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断 ![]()
【解析】
(1)打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O,反应后,硫酸变成稀硫酸,与铜不反应,再打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,结合二氧化硫的密度分析解答;
(2)①用D装置测定SO2的体积必须做到不能在测量时损耗二氧化硫,据此分析解答;②由于Cu(OH)2开始沉淀的pH约为5,因此滴定操作应选择变色范围接近pH=5的指示剂,且不能生成Cu(OH)2,否则会干扰滴定终点的判断;再根据H2SO4+2NaOH=Na2SO4+2H2O计算原余酸的物质的量。
(1)①打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O,反应的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,反应的化学方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,反应的化学方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2=2CuSO4+2H2O;
CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2=2CuSO4+2H2O;
②铜跟浓硫酸反应生成了二氧化硫气体,二氧化硫的密度比空气大,可以用向上排气法收集,所以装置中的导气管应长进短出,装置图为 ,故答案为:
,故答案为: ;
;
(2)①测定SO2的量必须准确测定无气体损耗,甲用排水法测定装置A产生气体的体积,实验方案中D装置中的试剂应该与二氧化硫不反应,且二氧化硫在其中溶解度较小,二氧化硫在饱和NaHSO3溶液中的溶解度较小,所以可用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,故答案为:饱和NaHSO3;
②由于Cu(OH)2开始沉淀的pH约为5,因此滴定操作应选择变色范围接近pH=5的指示剂,以减小滴定误差,故选择甲基橙作指示剂,若用酚酞作指示剂时溶液中的Cu 2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断;设余酸的物质的量为n,消耗NaOH的物质的量为:a mol/L×b×10-3 L=ab×10-3 mol,根据H2SO4+2NaOH=Na2SO4+2H2O可知滴定过程中消耗H2SO4的物质的量=![]() ×ab×10-3 mol,因此原余酸的物质的量为
×ab×10-3 mol,因此原余酸的物质的量为![]() ×ab×10-3 mol×
×ab×10-3 mol×![]() =
=![]() ×ab×10-3 mol,故答案为:甲基橙;Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,
×ab×10-3 mol,故答案为:甲基橙;Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,![]() ×ab×10-3。
×ab×10-3。

【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L