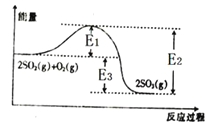
题目内容
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
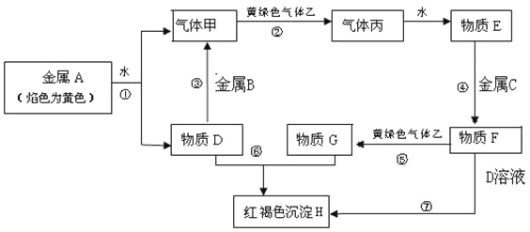
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_______、F________、H________。
(2)反应过程⑦可能观察到的实验现象______,反应的化学方程式为④_________。
(3)反应⑤的离子方程式为__________。
(4)反应①-⑦的7个反应属于氧化还原反应反应的有 ________(填选项代号)。
A.①②④⑤⑥ B.②③④⑥⑦ C.①②③④⑤⑦ D.全部
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为___________。
【答案】Na FeCl2 Fe(OH)3 先生成白色沉淀,迅速变成灰绿色,最后变成红褐色 Fe+2HCl=FeCl2+H2↑ 2Fe2++Cl2=2Fe3++2Cl- C Na2CO3+Cl2+H2O=NaHCO3+NaCl+NaClO
【解析】
金属A的焰色为黄色,则A为金属Na;Na与水反应生成NaOH和H2,气体甲为H2,黄绿色气体乙为Cl2,两者反应得到HCl,溶于水得到盐酸;物质D为NaOH溶液,金属B能够与NaOH反应,则金属B为Al;H为红褐色沉淀,H为Fe(OH)3;则金属C为Fe,Fe和盐酸反应得到的物质F为FeCl2,FeCl2与Cl2得到FeCl3。
(1)根据分析,A为Na;F为FeCl2;H为Fe(OH)3;
(2)FeCl2溶液和NaOH溶液反应,先生成Fe(OH)2,Fe(OH)2再被空气中的O2氧化得到Fe(OH)3,可看到现象:先生成白色沉淀,迅速变成灰绿色,最后变成红褐色;化学反应④,为铁和盐酸的反应,化学方程式为Fe+2HCl=FeCl2+H2↑;
(3)反应⑤为FeCl2和Cl2的反应,生成FeCl3,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(4)反应①为Na与水的反应生成H2和NaOH,Na的化合价升高为氧化还原反应;
反应②为H2和Cl2的反应生成HCl,H的化合价升高,为氧化还原反应;
反应③为Al和NaOH的反应生成NaAlO2和H2,Al的化合价升高,为氧化还原反应;
反应④Fe和HCl的反应,Fe的化合价升高,为氧化还原反应;
反应⑤FeCl2和Cl2的反应,Fe的化合价从+2价升高到+3价,是氧化还原反应;
反应⑥为NaOH与FeCl3的反应生成Fe(OH)3和NaCl,复分解反应,不是氧化还原反应;
反应⑦FeCl2与NaOH溶液反应,最终得到Fe(OH)3,Fe的化合价升高,为氧化还原反应;
属于氧化还原反应的有①②③④⑤⑦,答案选C;
(5) 纯碱溶液为Na2CO3,通入氯气,得到NaClO,具有漂白效果,反应中氯的化合价升高,也降低,得到NaCl,化学方程式为Na2CO3+Cl2+H2O=NaHCO3+NaCl+NaClO。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
下列说法不正确的是( )
A.前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B.达到平衡时,需要从外界吸收的能量为0.968 kJ
C.增大水的浓度,可以改变待反应的限度
D.使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
【题目】某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10 mL 2 mol·L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
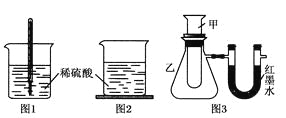
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红
墨水液面高低判断某反应是吸热反应还是放热反应。
序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
① | 氧化钙与水 | 左低右高 |
② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
③ | 铝片与烧碱溶液 | 左低右高 |
④ | 铜与浓硝酸 | 左低右高 |
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写 出该反应的离子方程式:___________。
(2)方案一中,温度升至最大值后又下降的原因是___________。
(3)方案二中,小木片脱落的原因是________,由此得出的结论是__________________。
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边________(填“高于”“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是______________。
(6)方案三实验②的U形管中的现象为________,说明反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量