题目内容
【题目】Ⅰ、工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO3(g),反应过程中能量的变化如图所示。
2SO3(g),反应过程中能量的变化如图所示。
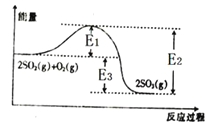
(1)由图可知该反应的正反应为_______(填“吸热”或“放热”)反应。
(2)向反应体系中加入催化剂后,图中E1_____(填“增大”“减小”或“不变”,下同),E3______。
Ⅱ、如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
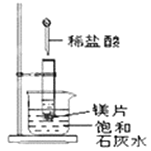
(3)写出试管内反应的离子方程式___________________________;
(4)实验中观察到石灰水中的现象:Ⅰ镁片溶解、Ⅱ镁片上产生大量气泡、Ⅲ_________________,产生上述现象Ⅲ的原因是____________________________。
(5)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
【答案】放热 减小 不变 Mg+2H+=Mg2++H2↑ 烧杯中析出晶体 镁与盐酸反应产生氢气,该反应为放热反应,![]() 在水中的溶解度随温度升高而减小,故析出
在水中的溶解度随温度升高而减小,故析出![]() 晶体; 小于
晶体; 小于
【解析】
Ⅰ.(1)由图象可知反应物总能量大于生成物总能量;
(2)加入催化剂,可降低反应的活化能,但反应热不变;
Ⅱ.镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,反应物总能量高于生成物总能量的反应为放热反应,据此解答。
(1)由图象可知反应物总能量大于生成物总能量,则该反应的正反应为放热反应;
(2)E1为活化能,E3为反应热,加入催化剂,可降低反应的活化能,但反应热不变;
(3)镁与盐酸反应生成氯化镁和氢气,离子方程式为:Mg+2H+=Mg2++H2↑;
(4)镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,饱和石灰水中会有氢氧化钙沉淀析出,所以看到的现象为Ⅰ.镁片上有大量气泡产生;Ⅱ.镁片逐渐溶解;Ⅲ.烧杯中析出晶体;
(5)反应物总能量高于生成物总能量的反应为放热反应,镁与盐酸反应产生氢气,该反应为放热反应,所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量。

【题目】氢气是一种重要的清洁能源。
(1)航天员呼吸产生的![]() 利用
利用![]() 反应:
反应:![]() H,再电解水可实现
H,再电解水可实现![]() 的循环利用。
的循环利用。
①热力学中规定,由最稳定单质生成![]() 某物质的焓变称为该物质的标准生成焓(符号:
某物质的焓变称为该物质的标准生成焓(符号:![]() ),最稳定单质的标准生成焓规定为0。已知上述反应式中:
),最稳定单质的标准生成焓规定为0。已知上述反应式中:
![]() ;
;![]() ;
;![]() ;
;
![]() ;则
;则![]() _____
_____![]() 。
。
②![]() 反应必须在高温下才能进行,原因是___________________________。
反应必须在高温下才能进行,原因是___________________________。
③350℃时,向体积为![]() 的恒容密闭容器中通入
的恒容密闭容器中通入![]() 和
和![]() 发生以上反应。
发生以上反应。
测得反应过程中压强随时间的变化如下表所示:
时间/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强 |
|
|
|
|
|
|
|
350℃时![]() 反应的
反应的![]() ______(
______(![]() 为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
(2)利用乙醇重整制氢是获得氢能的研究热点,其主要反应原理为:
反应Ⅰ: ![]() H1
H1
若同时通入水蒸汽,还会发生如下反应
反应Ⅱ:![]() H2
H2
反应Ⅲ:![]() H3
H3
反应Ⅳ:![]() H4
H4
一定温度下,某恒压密闭容器中充入一定量的![]() 发生反应。
发生反应。
已知:氢气选择性指转化的原料气中,转化成氢气的氢元素质量与转化的氢元素总质量的比值。
①下列有关说法正确的是_______________。
A.当混合气的平均相对分子质量不变时,说明反应达到平衡状态
B.增大乙醇初始浓度,能够提高乙醇的平衡转化率
C.其它条件不变,掺入稀有气体,可提高乙醇平衡转化率
D.其它条件不变,掺入水蒸气,可提高氢气的选择性和氢气的体积分数
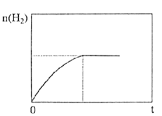
②下图为上述条件下n(H2)随反应时间的变化曲线图。若其它初始条件相同,只把容器变为恒容密闭容器,请画出恒容条件下,n(H2)随反应时间的变化曲线图________________。
③乙醇重整制氢过程中,还可能生成固态炭,固态炭的生成会造成催化剂失活,应尽量避免。研究其它条件相同下,反应温度、氧醇比、水醇比与生成固态炭的条件,得到下图:
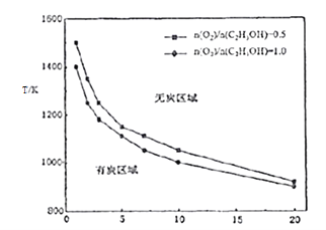
试根据图象分析,反应温度、氧醇比、水醇比对固态炭生成的影响_____________。