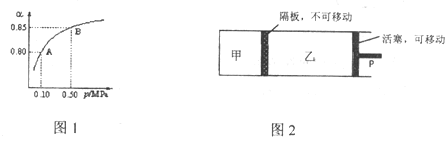
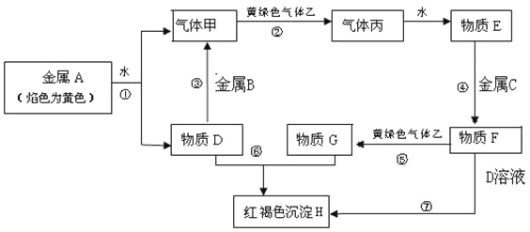
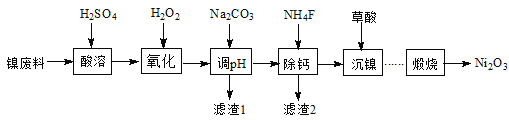
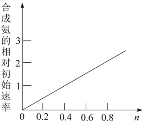
题目内容
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)这三种金属中金属活动性最强的是______ (填元素符号)
(2)画出铝的原子结构示意图________ 。
(3)写出氯化铝的电离方程式________ 。
(4)把一小块金属钠投入水中,观察到以下各种现象:钠浮在水面上,熔成闪亮的小球,四处游动,逐渐减少,直至消失。写出该反应的化学方程式______;其中钠熔成闪亮小球的原因是_______。钠完全反应后,收集到标准状况下的氢气2.24L,则参加反应的钠的物质的量为______ mol。
(5)将(4)所得溶液平均分成两份:
①一份加入足量的铝片充分反应,写出该反应的离子方程式:___________。
②向另一份溶液中滴加FeCl3溶液至沉淀不再增加,写出生成沉淀的反应的离子方程式__________;继续将沉淀过滤、洗涤、干燥、灼烧,此时得到的固体为_____(填化学式)。
【答案】Na 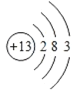 AlCl3=Al3++3Cl- 2Na+2H2O=2NaOH+H2↑ 钠的熔点较低,钠与水反应是放热反应,放出的热量使钠熔化,形成银白色小球 0.2 2Al+2OH -+2H2O=2AlO2-+3H2↑ Fe3++3OH-=Fe(OH)3↓ Fe2O3
AlCl3=Al3++3Cl- 2Na+2H2O=2NaOH+H2↑ 钠的熔点较低,钠与水反应是放热反应,放出的热量使钠熔化,形成银白色小球 0.2 2Al+2OH -+2H2O=2AlO2-+3H2↑ Fe3++3OH-=Fe(OH)3↓ Fe2O3
【解析】
(1)Na、Al、Fe,按照金属活动顺序表,越前面的金属,其活动性越强,这三种金属中,Na的排序最前,因此金属活动性最强的是Na;
(2)Al,为13号元素,其结构示意图为 ;
;
(3)AlCl3在水溶液中电离出Al3+和Cl-,则其电离方程式为AlCl3=Al3++3Cl-;
(4)金属钠和水发生反应生成NaOH和H2,化学方程式为2Na+2H2O=2NaOH+H2↑;钠的熔点较低,钠与水反应是放热反应,放出的热量使钠熔化,形成银白色小球。标准状况下的氢气2.24L,其物质的量为0.1mol,根据化学方程式,每生成1molH2消耗2molNa,生成0.1molH2,消耗0.2molNa;
(5)钠与水反应后的溶液为NaOH:
①Al和NaOH溶液反应,得到NaAlO2和H2,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
②FeCl3溶液与NaOH溶液反应,得到红褐色沉淀Fe(OH)3,离子方程式为Fe3++3OH-=Fe(OH)3↓;Fe(OH)3受热分解,得到Fe2O3。

【题目】已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
现有两个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molA和1molB,在Ⅱ中充入1molC和1 molD,800℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中的压强相等B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中C的体积分数比容器Ⅱ中的小D.容器Ⅰ中A的浓度比容器Ⅱ中的小