题目内容
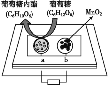
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
下列说法不正确的是( )
A.前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B.达到平衡时,需要从外界吸收的能量为0.968 kJ
C.增大水的浓度,可以改变待反应的限度
D.使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
【答案】D
【解析】
A.用水的浓度变化表示的平均反应速率v(H2O) =0.0010 mol×2÷2L÷20 min=5×10-5mol·L-1·min-1,故A正确;
B.达到平衡时,需要从外界吸收的能量为0.002 0 mol×484 kJ·mol-1=0.968 kJ,故B正确;
C.增大水的浓度,条件改变(压强增大),其反应限度发生改变,故C正确;
D.催化剂氧化亚铜只改变反应速率,不能改变化学反应限度,平衡时氧气的体积分数不变,故D错误;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,符合图像的一组是

X | Y | |
A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
D | NaAlO2、氨水、NaOH | H2SO4 |