题目内容
【题目】某研究性学习小组设计了用氧化浓盐酸的方法制取氯气的实验,其实验装置如下图:
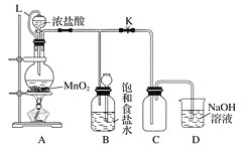
(1)写出圆底烧瓶中发生反应的化学方程式:___________________________________。
(2)如果将过量的二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要的原因有①______________________;②_________________。
(3)L的作用是____________________;B的作用是_________________。
(4)为了提高浓盐酸的利用率,你对实验的建议是____________。
【答案】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 反应中HCl消耗,盐酸变稀,稀盐酸不能与MnO2反应 加热中有部分HCl挥发而损失 恒压条件下确保浓盐酸能顺利滴加 利用氯气在饱和食盐水中溶解度很小的性质而贮存氯气 将浓盐酸慢慢滴下;加热时用小火慢慢加热等
MnCl2+2H2O+Cl2↑ 反应中HCl消耗,盐酸变稀,稀盐酸不能与MnO2反应 加热中有部分HCl挥发而损失 恒压条件下确保浓盐酸能顺利滴加 利用氯气在饱和食盐水中溶解度很小的性质而贮存氯气 将浓盐酸慢慢滴下;加热时用小火慢慢加热等
【解析】
1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,随着反应的进行,盐酸的浓度逐渐减小,浓盐酸易挥发;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水;
(4)依据浓盐酸易挥发性,控制浓盐酸的用量。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,答案为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;
(2)盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,答案为:反应中HCl消耗,盐酸变稀,稀盐酸不能与MnO2反应;加热中有部分HCl挥发而损失;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用,便于液体顺利流下;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用饱和食盐水吸收氯气中的氯化氢;答案为:恒压条件下确保浓盐酸能顺利滴加;利用氯气在饱和食盐水中溶解度很小的性质而贮存氯气;
(4)因为浓盐酸易挥发,为了提高浓盐酸的利用率,应小火加热,答案为:将浓盐酸慢慢滴下;加热时用小火慢慢加热等。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
现有两个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molA和1molB,在Ⅱ中充入1molC和1 molD,800℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中的压强相等B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中C的体积分数比容器Ⅱ中的小D.容器Ⅰ中A的浓度比容器Ⅱ中的小