��Ŀ����
����Ŀ���ҹ��Ǹ������������������Ϊ�����һ����¯��������Ϊ�ձ������������
I����֪��2CO(g)+O2(g)=2CO2(g) ��H=-566kJ/mol
2Fe(s)+ ![]() O2(g)=Fe2O3(s) ��H=-825.5 kJ/mol
O2(g)=Fe2O3(s) ��H=-825.5 kJ/mol
��(1)��Ӧ��Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ��H=____________��
2Fe(s)+3CO2(g) ��H=____________��
(2)��Ӧ ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g)��1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����l0min��ﵽƽ�⣬��CO��ƽ��ת����=____________��
Fe(s)+CO2(g)��1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����l0min��ﵽƽ�⣬��CO��ƽ��ת����=____________��
II����¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״���CO(g)+2H2(g)![]() CH3OH(g)�������ͼʾ�ش��������⣺
CH3OH(g)�������ͼʾ�ش��������⣺


(1)�ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)= _________��CO(g)+2H2(g)![]() CH3OH(g) ��H=___________��
CH3OH(g) ��H=___________��
(2)�����¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���

�����й�ϵ��ȷ���� ____________��
A. c1=c2 B.2Q1=Q3 C. 2a1=a3
D.a1+a2 =1 E.�÷�Ӧ������1mol CH3OH����ų�(Q1+Q2)kJ����
(3)����һ����ɱ���ܱ������г���l molCO�� 2mol H2��1mol CH3OH���ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6������÷�Ӧ��____________ (����������������)��Ӧ�����ƶ���
III����һ���ܱ������У���һ�����ҿɻ������壬���߷ֱ���п��淴Ӧ�������ʵ����ʵ����ֱ����£�M��N��PΪ2.5mol��3.0mol��1.0mol��A��C��D��Ϊ0.50mol��B�����ʵ���Ϊx mol����x��һ����Χ�ڱ仯��������ͨ�����ڷ�Ӧ�����¶ȣ�ʹ���෴Ӧ���ﵽƽ�⣬�Ҹ����ڷ�Ӧ��������λ�á��ﵽƽ����M��ת����Ϊ75%����д�հף�
![]()
(1)�ﵽƽ���Ӧ�����������ܵ����ʵ���Ϊ____________mol��
(2)��Ҫʹ���ҷ�Ӧ��ʼʱV��>V����x��ȡֵ��Χ______________________��
(3)��Ҫʹ���ҷ�Ӧ��ʼʱV��<V����x��ȡֵ��Χ________________________��
���𰸡���H=-23.5kJ/mol 60% 0.15mol/(L��min) ��H=-91 kJ/mol ADE �� 3.5 2<x<3 1.5<x<2
��������
I����2CO(g)+O2(g)=2CO2(g)��H=-566kJ/mol
��2Fe(s)+ ![]() O2(g)=Fe2O3(s) ��H=-825.5 kJ/mol
O2(g)=Fe2O3(s) ��H=-825.5 kJ/mol
�ɸ�˹���ɢ���![]() ���ڵõ�Fe2O3(s)+3CO(g)
���ڵõ�Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ��H=-566��
2Fe(s)+3CO2(g) ��H=-566��![]() +825.5=-23.5kJ/mol��
+825.5=-23.5kJ/mol��
(2)����ƽ��ʱCO�����ʵ����仯Ϊnmol����
![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
��ʼ(mol)�� 1 1
�仯(mol)�� n n
ƽ��(mol)�� 1-n n+1
����![]() =4�����n=0.6����CO��ƽ��ת����Ϊ
=4�����n=0.6����CO��ƽ��ת����Ϊ![]() ��
��
II��(1)�ﵽƽ��ʱ���ɼ״������ʵ���c(CH3OH)=0.75mol/L�������ĵ�c(H2)=2��0.75mol/L=1.5mol/L��v(H2)=![]() =
=![]() =0.15mol/(Lmin)��CO(g)+2H2(g)
=0.15mol/(Lmin)��CO(g)+2H2(g)![]() CH3OH(g) ��H=(419 kJ/mol)-(510kJ/mol)=-91kJ/mol��
CH3OH(g) ��H=(419 kJ/mol)-(510kJ/mol)=-91kJ/mol��
(2)A.�ס�����Ƚϣ����ҵ�ЧΪ��ʼ����1mol CO��2mol H2�������ǵ�Чƽ�⣬����ƽ��ʱ�״���Ũ��c1=c2��A��ȷ��
B.�ס�����Ƚϣ����з�Ӧ������ʵ���Ϊ��2����ѹǿ�����ڷ�ӦCO(g)+2H2(g)![]() CH3OH(g)��ƽ�������ɼ״��ķ����ƶ���2Q1��Q3��B����
CH3OH(g)��ƽ�������ɼ״��ķ����ƶ���2Q1��Q3��B����
C.�ס�����Ƚϣ����з�Ӧ������ʵ���Ϊ��2����ѹǿ�����ڷ�ӦCO(g)+2H2(g)![]() CH3OH(g)��ƽ�������ɼ״��ķ����ƶ���a1��a3��C����
CH3OH(g)��ƽ�������ɼ״��ķ����ƶ���a1��a3��C����
D.�ס��Ҵ�����ͬ��ƽ��״̬�����ҷ�Ӧ�����෴������1+��2=1��D��ȷ��
E.�ס��Ҵ�����ͬ��ƽ��״̬�����ҷ�Ӧ�����෴����������ת���ĺ�ǡ��Ϊ1mol�����Ը÷�Ӧ������1mol CH3OH����ų�(Q1+Q2)kJ������E��ȷ��
�ʺ���ѡ����ADE��
(3)��Ӧǰ���������������䣬ͬ�¡�ͬѹ�£��ﵽƽ��ʱ�������ܶ��������������С��ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��.6�����������ʵ�����Ϊԭ�ȵ�![]() ���������ʵ���=4��
���������ʵ���=4��![]() =2.5mol����Ӧǰ�������1.5mol������ѧ��Ӧ��������Ӧ���������
=2.5mol����Ӧǰ�������1.5mol������ѧ��Ӧ��������Ӧ���������
III��(1)�����еĿ��淴Ӧ�У���Ӧǰ�������������䣬��ﵽƽ��ʱ����������ʵ������䣬��ӦǰMΪ2.5mol��PΪ1mol�������ʵ���Ϊ��2.5mol+1mol=3.5mol����ﵽƽ��ʱ��������ʵ���Ҳ��3.5mol��
(2)�ﵽƽ��ʱ���ҿɻ������崦���м䣬˵���ﵽƽ��ʱ���Һ���������������ʵ�����ȣ�����3.5mol�������еķ�ӦΪ���������С�ķ�Ӧ������ӦA(g)+4B(g)![]() 2C(g)+D(g)�����������������ʵ����ʵ���Ϊ3.5mol����ƽ�ⲻ�ƶ�ʱ��B�����ʵ�����С��������V����V������B�����ʵ������ڣ�3.5mol-0.5mol��3=2�����ﵽƽ��ʱ����ȫ��ΪC��Dʱ��B�����ʵ�������ݷ�ӦA(g)+4B(g)
2C(g)+D(g)�����������������ʵ����ʵ���Ϊ3.5mol����ƽ�ⲻ�ƶ�ʱ��B�����ʵ�����С��������V����V������B�����ʵ������ڣ�3.5mol-0.5mol��3=2�����ﵽƽ��ʱ����ȫ��ΪC��Dʱ��B�����ʵ�������ݷ�ӦA(g)+4B(g)![]() 2C(g)+D(g)��0.5molA��ȫ��Ӧ����2molB��ͬʱ����1molC��0.5molC����ʱC�������ʵ���Ϊ1mol+0.5mol=1.5mol��D�����ʵ���Ϊ0.5mol+0.5mol=1mol�������ʵ���Ϊ��1.5mol+1mol=2.5mol��ʣ���3.5-2.5mol=1molΪBʱ��B�����ʵ����������B�����ʵ������Ϊ��2mol+1mol=3mol������x�Ƿ�ΧΪ��2.0��x��3.0��
2C(g)+D(g)��0.5molA��ȫ��Ӧ����2molB��ͬʱ����1molC��0.5molC����ʱC�������ʵ���Ϊ1mol+0.5mol=1.5mol��D�����ʵ���Ϊ0.5mol+0.5mol=1mol�������ʵ���Ϊ��1.5mol+1mol=2.5mol��ʣ���3.5-2.5mol=1molΪBʱ��B�����ʵ����������B�����ʵ������Ϊ��2mol+1mol=3mol������x�Ƿ�ΧΪ��2.0��x��3.0��
(3)�ﵽƽ��ʱ���ҿɻ������崦���м䣬˵���ﵽƽ��ʱ���Һ���������������ʵ�����ȣ���Ϊ3.5mol�������е��淴ӦΪ�������ķ�Ӧ������ӦA(g)+4B(g)![]() 2C(g)+D(g)�����������������ʵ����ʵ���Ϊ3.5mol����ƽ�ⲻ�ƶ���B�����ʵ������������V����V������B�����ʵ���С�ڣ�3.5mol-0.5mol��3=2�����ﵽƽ��ʱ����ȫ��ΪA��Bʱ��B�����ʵ�����С�����ݷ�ӦA(g)+4B(g)
2C(g)+D(g)�����������������ʵ����ʵ���Ϊ3.5mol����ƽ�ⲻ�ƶ���B�����ʵ������������V����V������B�����ʵ���С�ڣ�3.5mol-0.5mol��3=2�����ﵽƽ��ʱ����ȫ��ΪA��Bʱ��B�����ʵ�����С�����ݷ�ӦA(g)+4B(g)![]() 2C(g)+D(g)��0.5molC��ȫ��Ӧ����1molB����ʱB�����ʵ���Ϊ��1mol+0.5mol������V����V����ƽ�����������ƶ�����B�����ʵ���һ������1.5mol������x�Ƿ�ΧΪ��1.5��x��2.0��
2C(g)+D(g)��0.5molC��ȫ��Ӧ����1molB����ʱB�����ʵ���Ϊ��1mol+0.5mol������V����V����ƽ�����������ƶ�����B�����ʵ���һ������1.5mol������x�Ƿ�ΧΪ��1.5��x��2.0��

 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�����Ŀ��ij�¶��£�H2(g)+CO2(g) ![]() H2O(g)+CO(g)��ƽ�ⳣ��K=
H2O(g)+CO(g)��ƽ�ⳣ��K= ![]() �����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�������ʾ�������жϲ���ȷ����(����)
�����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�������ʾ�������жϲ���ȷ����(����)
��ʼŨ�� | �� | �� | �� |
c(H2)/(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(/mol/L) | 0.010 | 0.010 | 0.020 |
A. ƽ��ʱ������CO2��ת���ʴ���60%
B. ƽ��ʱ�����кͱ���H2��ת���ʾ���60%
C. ƽ��ʱ������c(CO2)�Ǽ��е�2������0.012 mol/L
D. ��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
����Ŀ������ʵ������������ܹ������Ӧʵ����۵���(����)
ѡ�� | ʵ����������� | ���� |
A | ��ij��Һ�м���BaCl2��Һ���а�ɫ�������� | ��Һ��һ������ |
B | ��ij��Һ�м������ᣬ������ʹ����ʯ��ˮ����ǵ���ɫ���� | ��Һ��һ������ |
C | ��ij��Һ���ȼ��������ữ��û�����������ټ���BaCl2��Һ���а�ɫ�������� | ��Һ��һ������SO42�� |
D | ��5mL������ˮ�еμ�����0.1 mol/L NaBr��Һ����Һ����ɫ��Ϊ�Ȼ�ɫ���ٵμ�����0.1 mol/L����-KI��Һ����Һ���� | ������ǿ����Cl2>Br2>I2 |
A.AB.BC.CD.D
����Ŀ��������KMnO4��H2C2O4����������Ӧ�о�Ӱ�췴Ӧ���ʵ����ء�һʵ��С����ͨ���ⶨ��λʱ��������CO2�����ʣ�̽��ij��Ӱ�컯ѧ��Ӧ���ʵ����أ����ʵ�鷽��������KMnO4��Һ���ữ����
ʵ����� | A��Һ | B��Һ |
�� | 20 mL 0.1 mol��L��1H2C2O4��Һ | 30 mL 0.01 mol��L��1KMnO4��Һ |
�� | 20 mL 0.2 mol��L��1H2C2O4��Һ | 30 mL 0.01 mol��L��1KMnO4��Һ |

��1���÷�Ӧ�����ӷ���ʽ ������֪H2C2O4�Ƕ�Ԫ������
��2����ʵ��̽������ ���ضԻ�ѧ��Ӧ���ʵ�Ӱ�졣��ͬʱ������Ͳ������CO2�������С��ϵ�� �� ����ʵ���������
��3����ʵ������2 minĩ�ռ���2.24 mL CO2����״������������2 minĩ�� c��MnO4������__________mol/L��������Һ���Ϊ50 mL��
��4����ͨ���ⶨһ��ʱ����CO2��������ȽϷ�Ӧ���ʣ���ʵ�黹��ͨ���ⶨ ���Ƚϻ�ѧ��Ӧ���ʡ���һ��������
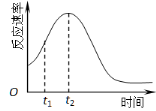 ��5��С��ͬѧ���ַ�Ӧ����������ͼ������t1��t2ʱ�������ʱ�����Ҫԭ������ǣ�
��5��С��ͬѧ���ַ�Ӧ����������ͼ������t1��t2ʱ�������ʱ�����Ҫԭ������ǣ�

�� ���� ��
����Ŀ���±���Ԫ�����ڱ���ǰ�����ڣ���ش��й����⣺����ؾ��þ��廯ѧ����ش�
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� | ||||||
��1��Ԫ�آݢޢߵļ����Ӱ뾶��С˳��__________������Ԫ�����ڱ�λ��________���۵ļ��⻯��͢���⻯�����γɵĻ��������ʽ__________��
��2���������������ˮ����͢���������ﷴӦ�����ӷ���ʽ_______
��3���õ���ʽ��ʾԪ�آٺ͢��γɵĻ�������γɹ���__________��
��4���ܡ��ࡢ����⻯��е���ߵ���__________��ԭ����__________��
��5���ɢں͢�������������O2�͢������������Ӧ��ˮ�����ˮ��Һ���ȼ�ϵ�أ�д����صĸ�����Ӧʽ__________��


