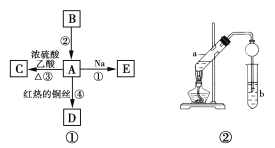
题目内容
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
【答案】 S2->Na+>Al3+ 第二周期第IVA族 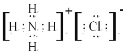 Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O ![]() HF HF分子间有氢键 CH4+10OH--8e-=CO3 -+7H2O
HF HF分子间有氢键 CH4+10OH--8e-=CO3 -+7H2O
【解析】由元素在周期表中位置,可以知道①为H、②为C、③为N、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br。根据元素的元素周期律进行解答。
(1)元素⑤为Na、⑥为Al、简单离子电子层数相同均为2个电子层,核外电子排布相同的微粒,核电荷数越大半径约小,所以Na+>Al3+,⑦为S简单离子为3个电子层所以微粒半径大小为:S2->Na+>Al3+;②为C核电荷数为6,,在元素周期表位置为第二周期第IVA族;③为N,简单氢化物NH3,⑧为Cl其氢化物为HCl混合形成的化合物为NH4Cl,属于离子化合物,电子式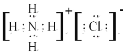 。
。
(2)⑤为Na其最高价氧化物水合物为NaOH, ⑥为Al的最高价氧化物为Al2O3,NaOH,和Al2O3反应的离子方程式Al2O3+2OH-=2AlO2-+H2O。
(3)元素①为H,⑧为Cl,两者形成的化合物为HCl属于共价化合物,其形成过程电子式为:![]() 。
。
(4)④为F、⑧为Cl、⑩为Br他们的氢化物分别为HF、HCl、HBr,根据元素周期律知F、Cl、Br的非金属性逐渐减弱,但HF分子间能形成氢键,所以沸点最高的是HF,答案:HF ;HF分子间有氢键。
5)由②为C和①为H组成最简单物质为CH4,,与O2组成燃料电池,电解质为KOH的水溶液CH4做负极,其电极反应式为CH4+10OH--8e-=CO3-+7H2O。

【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件).
(2)探究反应条件对0.10mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.