题目内容
19.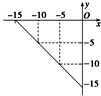 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.x与y的关系如图所示:则该温度下0.01mol/L NaOH溶液的pH为13.
分析 从图中数据计算离子积常数=c(H+).c(OH-),根据离子积常数计算氢离子浓度,进而求pH.
解答 解:根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5.10-10=10-15,该温度下,0.01mol/L氢氧化钠溶液中氢离子浓度=$\frac{1{0}^{-15}}{0.01}$=10-13,pH=-1g10-13=13,
故答案为:13.
点评 本题考查了溶液pH的有关计算,注意离子积常数=c(H+)•c(OH-)的应用,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列各组稀溶液:①氨水和硝酸银 ②氯化铝和氢氧化钠 ③硫酸氢铵和氢氧化钡 ④硝酸和碳酸钠.只用试管、滴管及闻气味就能鉴别的是( )
| A. | ③④ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
8.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 用激光笔分别照射盛有牛奶、食盐水的玻璃杯,都有光亮的通路 | |
| B. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,转换材料是二氧化硅 | |
| C. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| D. | 可以用物理方法或化学方法从海水中提取所需物质 |
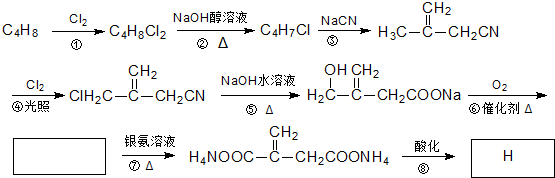
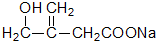 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2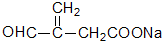 +2H2O;其反应类型是氧化反应;
+2H2O;其反应类型是氧化反应;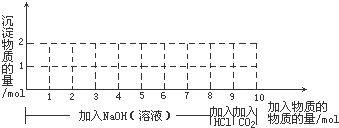
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2. .
.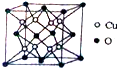 铜是应用广泛的有色金属.
铜是应用广泛的有色金属.