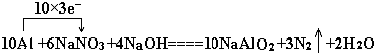题目内容
4. 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.请回答下列问题:
(1)实验室制备乙烯的反应方程式是:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O.
(2)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:
ⅠA;ⅡB;ⅢA;ⅣD. (选填有关试剂的序号)
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(3)能说明SO2气体存在的现象是装置Ⅰ中品红褪色.
(4)使用装置Ⅱ的目的是除去SO2以免干扰乙烯的检验.
(5)使用装置Ⅲ的目的是检验SO2是否被完全除去.
(6)确定含有乙烯的现象是装置III中品红不褪色,装置Ⅳ中酸性KMnO4溶液褪色.
分析 实验室要制备纯净的乙烯并检验乙烯,原理为乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应,因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,要检验乙烯,借助其还原性,能够使酸性的高锰酸钾褪色,但是二氧化硫的存在对乙烯的检验造成干扰,应先检验二氧化硫的存在,然后除去二氧化硫,再用酸性的高锰酸钾检验乙烯的存在.
(1)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体;
(2)I中检验二氧化硫用品红溶液,II中NaOH除去二氧化硫,Ⅲ中品红检验二氧化硫除尽,Ⅳ中用高锰酸钾酸性溶液褪色检验乙烯;
(3)二氧化硫具有漂白性;
(4)二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色;
(5)检验二氧化硫是否除尽;
(6)乙烯具有还原性,能够使酸性的高锰酸钾褪色.
解答 解:(1)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体化学方程式:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O;
故答案为:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O;
(2)I中检验二氧化硫用品红溶液,II中NaOH除去二氧化硫,Ⅲ中品红检验二氧化硫除尽,Ⅳ中用高锰酸钾酸性溶液褪色检验乙烯;
故答案为:I A;II B;II A;IV D
(3)二氧化硫具有漂白性,能说明SO2气体存在的现象是:装置Ⅰ中 品红褪色;
故答案为:装置Ⅰ中 品红褪色;
(4)二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色,为检验乙烯,应除去二氧化硫;
故答案为:除去SO2以免干扰 乙烯的检验;
(5)使用装置Ⅲ的目的是:检验SO2是否被完全除去;
故答案为:检验SO2是否被完全除去;
(6)乙烯具有还原性,能够使酸性的高锰酸钾褪色,确定含有乙烯的现象是:装置III中品红不褪色,装置Ⅳ中酸性 KMnO4溶液褪色;
故答案为:装置III中品红不褪色,装置Ⅳ中酸性 KMnO4溶液褪色.
点评 本题考查了乙烯的实验室制备,侧重考查实验的设计,明确实验原理及物质的性质和除杂检验的方法是解题关键,题目难度不大.

(1)据报道,美国海军科学家拟从海水中提取H2,从空气中提取CO2合成短链羟来代替汽油.已知氢气的燃烧热为-285.8kJ•mol-1;辛烷(C8H18,可作为汽油用)的燃烧热为-5518kJ•mol-1.写出CO2和H2合成辛烷的热化成方程式8CO2(g)+25H2(g)=C8H18(l)+16H2O(l)△H=-1627 k J•mol-1.
(2)二氧化碳加氢合成甲醇是其合理利用碳资源的有效途径之一,反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,下列能确定该条件下反应达到最大转化限度的是AB.
A、CO2含量不再变化 B、容器内压强不再变化
C、3v正(H2)=v逆(CH3OH) D、△H不再发生变化
②同时测得不同时刻的反应前后压强关系如下:
| 时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
列式计算该温度下CO2的平衡转化率:40%.
③若反应条件为压强6MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率℃为50%,该反应该条件的平衡常数KP=$\frac{1}{27}$(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);列举提高CO2转化率的措施增大氢气与CO2的比例或及时分离出甲醇或水蒸气.
(3)CO2和NaOH溶液反应可生成NaHCO3溶液,查阅资料得常温下H2CO3的电离平衡常数K1=4.2×10-7,K2=5.6×10-11;实验测得常温下0.1mol/L的NaHCO3的pH为8,则0.1mol/L的NaHCO3溶液中离子浓度大小顺序为A.
A、c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
B、c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C、c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
D、c(Na+)>c(OH-)>c(HCO3-)>c(H+)>c(CO32-)
| A. | 观察比较外观形态 | B. | 用手触摸比较 | ||
| C. | 放到嘴里品尝一下 | D. | 用化学方法进行鉴别 |
 A、B、C、D均是由短周期元素形成的四种气体单质,E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去):
A、B、C、D均是由短周期元素形成的四种气体单质,E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去):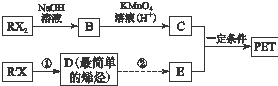 PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%. .
.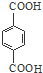 +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$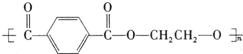 +2nH2O.
+2nH2O. 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知: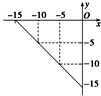 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.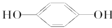 E; ③
E; ③ H;
H; I;⑤
I;⑤ G; ⑥
G; ⑥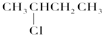 J.
J.