题目内容
在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为 摩尔/(升?秒).若此时再向该容器中投入a mol H2、a mol N2和2a mol NH3,判断平衡移动的方向是 (填“正向移动”“逆向移动”或“不移动”).
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:利用三段法计算出平衡时各物质的浓度,再计算氢气的反应速率及平衡常数,然后利用Q与K的关系来分析平衡的移动;
解答:
解:由4amolH2和2amolN2放入VL的密闭容器中,充分反应后测得N2的转化率为50%,则
N2 +3H2 2NH3
2NH3
开始mol/L 2×
4×
0
转化mol/L
3×
2×
平衡mol/L
2×
用H2表示的反应速率为
=0.6×
mol/(L?min)=
mol/(L?s),
K=
=
,
若此时再向该容器中投入amolH2、amolN2和2amolNH3,则浓度分别为:2×
mol/L; 2×
mol/L;4×
mol/L
则Q=
=
<K,则化学平衡正向移动,故答案为:
mol/(L?s);正向移动;
N2 +3H2
 2NH3
2NH3开始mol/L 2×
| a |
| V |
| a |
| V |
转化mol/L
| a |
| V |
| a |
| V |
| a |
| V |
平衡mol/L
| a |
| V |
| a |
| V |
| a |
| V |
用H2表示的反应速率为
| 3a/V |
| 5min |
| a |
| V |
| 0.01a |
| V |
K=
| (2a/V)2 |
| (a/V )4 |
| 4V2 |
| a2 |
若此时再向该容器中投入amolH2、amolN2和2amolNH3,则浓度分别为:2×
| a |
| V |
| a |
| V |
| a |
| V |
则Q=
| (4a/V)2 |
| (2a/V)4 |
| V2 |
| a2 |
| 0.01a |
| V |
点评:本题主要考查了反应速率的计算和化学平衡常数的应用,难度中等,解题时要注意根据平衡常数判断平衡移动方向的方法.

练习册系列答案
相关题目
X、Y、Z、W为四种短周期非金属元素,其中X单质是一种重要的半导体材料,X、Y、Z同周期,且原子序数依次增大,Y、W同主族,离子半径Y2->W2-.下列说法正确的是( )
| A、X的非金属性比Y的强 |
| B、X和W组成的化合物化学性质活泼,与盐酸和氢氧化钠溶液都能反应 |
| C、Y的气态氢化物不如Z的气态氢化物稳定 |
| D、某溶液中通入Z的单质,再滴加淀粉溶液显蓝色,原溶液中一定含有I- |
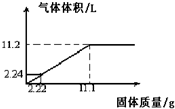 将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如图所示:
将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如图所示: 已知一定量的有机物A在氧气中完全燃烧,只生成0.2mol CO2和0.3mol H2O,试回答下列问题:
已知一定量的有机物A在氧气中完全燃烧,只生成0.2mol CO2和0.3mol H2O,试回答下列问题: