题目内容
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
| A.原子半径的大小顺序: Y<Z<W<X |
| B.化合物YX、ZX2、WX3中化学键的类型相同 |
| C.非金属性的强弱顺序:X>W>Z |
| D.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
C
解析试题分析:X原子的最外层电子数是其内层电子总数的3倍,则该元素只能是第二周期元素,是氧元素。W与X属于同一主族,因此W是S元素。Y原子的最外层只有2个电子,Z单质可制成半导体材料,且二者的原子序数均小于S的,而大于氧元素的,所以Y是Mg,Z是Si。同周期自左向右,原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,则四种元素的原子半径的大小顺序是Y>Z>W>X,选项A不正确;化合物MgO、SiO2、SO3中的化学键分别是离子键、共价键和共价键,选项B不正确;同周期自左向右非金属性逐渐减弱,同主族自上而下,非金属性逐渐增强,所以选项C正确;非金属性越强,最高价氧化物的水化物的酸性越强,所以硫酸的酸性强于硅酸的,D不正确,答案选C。
考点:考查元素周期表第结构和元素周期律的应用
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力

铀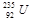 是重要的核工业原料,在自然界中的含量很低。下列有关铀
是重要的核工业原料,在自然界中的含量很低。下列有关铀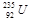 的说法正确的是
的说法正确的是
A.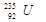 与 与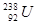 的性质完全相同 的性质完全相同 |
B.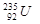 原子核中含有143个中子 原子核中含有143个中子 |
C.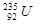 属于短周期元素 属于短周期元素 |
D.1mol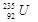 的质量是143g 的质量是143g |
铋(Bi)在医药方面有重要应用。 下列关于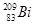 和
和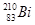 的说法正确的是
的说法正确的是
A.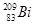 和 和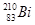 都含有83个中子 都含有83个中子 |
B.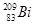 和 和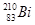 互为同位素 互为同位素 |
C.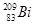 和 和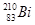 的核外电子数不同 的核外电子数不同 |
D.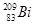 和 和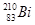 分别含有126和127个质子 分别含有126和127个质子 |
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是 ( )
| A.X能形成化学式为NaXO3的含氧酸钠盐 |
| B.X元素气态氢化物的水溶液呈酸性 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |
超铀元素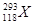 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子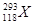 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |
(10分)下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(2)表中最活泼的金属是 ,非金属性最强的元素是 。(填元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素形成的单质与⑥、⑨最高价氧化物的水化物反应的化学方程式: 、 。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱: 。