题目内容
(14分) 2SO2(g)+ O2 (g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
温度/℃ | 400 | 500 | 600 |
SO2转化率/% | 99.2 | 93.5 | 73.7 |
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3?H2O)= 2[c()+ c()+ c(H2SO3)]
b. c()+ c(H+)= c()+ c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。


图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。
(14分)
(1)放热 0.08
(2)①ac
i. SO2+ H2O H2SO3 MnO2+ H2SO3===MnSO4+H2O(或MnO2+ SO2==MnSO4)
H2SO3 MnO2+ H2SO3===MnSO4+H2O(或MnO2+ SO2==MnSO4)
ii. 2SO2+ 2H2O +O2 === 2H2SO4
不利于 溶液中存在 SO2+ H2O  H2SO3
H2SO3 H++,当溶液中酸性增强,平衡向左移动,使SO2从体系中溢出。
H++,当溶液中酸性增强,平衡向左移动,使SO2从体系中溢出。
【解析】
试题分析:(1)温度升高二氧化硫的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应;
(2)该条件下二氧化硫的转化率为99.2%,所以10 mol SO2的原料气平衡时剩余10×(1-99.2%)=0.08mol SO2
(3)①根据物料守恒规律,c(NH4+)+c(NH3·H2O)=2c(H2SO3)+2c(SO32-)+ 2c(HSO3-),a正确;b不符合电荷守恒规律,错误;(NH4)2SO3溶液为碱性溶液,说明SO32-的水解程度大于NH4+的水解程度,所以溶液中离子浓度的大小关系是c(NH4+)>c(SO32-)>c(OH-)>c(H+),c正确;答案选ac;
②i.二氧化硫与水反应生成亚硫酸,亚硫酸与二氧化锰发生氧化还原反应生成硫酸锰,化学方程式为H2O+SO2 H2SO3 MnO2+ H2SO3= MnSO4+H2O;
H2SO3 MnO2+ H2SO3= MnSO4+H2O;
ii.SO2与水、氧气反应生成硫酸,化学方程式为2SO2+2H2O+ O2=2 H2SO4;由乙图可知,pH减小,二氧化硫的吸收率下降,所以pH的降低不利于SO2的吸收;因为二氧化硫溶于水后存在平衡H2O+SO2 H2SO3
H2SO3 H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
考点:考查反应的能量变化,化学平衡的移动,溶液中离子浓度的大小比较,化学方程式的判断与书写

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
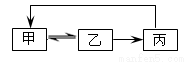
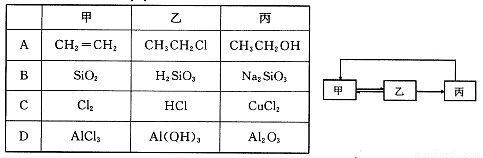
小学生10分钟应用题系列答案下表中各组物质之间不能通过一步反应实现右图转化的是
| 甲 | 乙 | 丙 |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | SiO2 | H2SiO3 | Na2SiO3 |
C | Cl2 | HCl | CuCl2 |
D | AlCl3 | Al(OH)3 | Al2O3 |