题目内容
(12分)科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
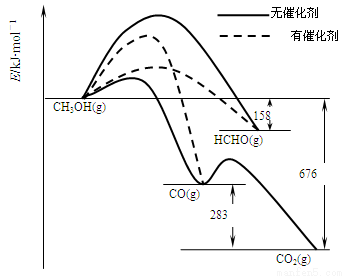
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ/mol
H=+1530 kJ/mol
又知:H2O(1)=H2O(g)  H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H2O(g)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
(1)① 减小 ②30% AD (2) +1266 c3(O2) c4(NH3)/ c2(N2) c6(H2O) 不变
【解析】
试题分析:(1)①催化剂能降低正逆反应的活化能,在反应体系中加入催化剂,反应速率增大,E2的变化是减小。②根据三行式计算;设发生反应的氮气的物质的量为x
N2(g)+3H2(g)  2NH3(g)
2NH3(g)
起始物质的量(mol)0.3 0.5 0
转化物质的量(mol)x 3x 2x
平衡物质的量(mol)0.3—x 0.5—3x 2x
根据题意及阿伏加德罗定律知,(0.8—2x)/0.8 =7/8,解得x=0.05mol,H2的转化率为0.15/0.5×100%=30%;欲提高该容器中H2的转化率,A.向容器中按原比例再充入原料气,相当于增大压强,合成氨的反应平衡正向移动,氢气的转化率增大,正确; B.向容器中再充入一定量H2,氢气的转化率降低,错误;C.改变反应的催化剂,平衡不移动,氢气的转化率不变,错误;D.液化生成物分离出氨,平衡正向移动,氢气的转化率增大,正确,选AD。 (2)已知:①2N2(g)+6H2O(1)  4NH3(g)+3O2(g) △H=+1530 kJ/mol②H2O(1)=H2O(g) △H=+44.0 kJ/mol,根据盖斯定律:①—②×6得
4NH3(g)+3O2(g) △H=+1530 kJ/mol②H2O(1)=H2O(g) △H=+44.0 kJ/mol,根据盖斯定律:①—②×6得
2N2(g)+6H2O(g)  4NH3(g)+3O2(g) △H =+1266kJ/mol;根据该反应的化学方程式及化学平衡常数的定义知,该反应的化学平衡常数表达式为K=c3(O2) c4(NH3)/ c2(N2) c6(H2O);影响化学平衡常数的外界条件为温度,控制其他条件不变,增大压强,K值不变。
4NH3(g)+3O2(g) △H =+1266kJ/mol;根据该反应的化学方程式及化学平衡常数的定义知,该反应的化学平衡常数表达式为K=c3(O2) c4(NH3)/ c2(N2) c6(H2O);影响化学平衡常数的外界条件为温度,控制其他条件不变,增大压强,K值不变。
考点:考查外界条件对化学反应速率、化学平衡的影响,平衡计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(14分) 2SO2(g)+ O2 (g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
温度/℃ | 400 | 500 | 600 |
SO2转化率/% | 99.2 | 93.5 | 73.7 |
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3?H2O)= 2[c()+ c()+ c(H2SO3)]
b. c()+ c(H+)= c()+ c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。


图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。