题目内容
3.将充满20mL NO试管倒置于盛有蒸馏水的烧杯中,然后向试管中通入纯O2,当试管内液面稳定在试管容积的一半时,则通入O2可能为( )| A. | 25.0mL | B. | 35.0mL | C. | 17.5mL | D. | 7.5mL |
分析 一氧化氮与氧气的反应为4NO+3O2+2H2O═4HNO3,当试管内液面稳定在试管容积的一半,说明反应后剩余气体体积为10mL;剩余的气体可能为一氧化氮,有可能为氧气,分别根据反应方程式计算出两种情况下需要氧气的体积.
解答 解:当试管内液面稳定在试管容积的一半,说明反应后剩余气体体积为10mL,
由4NO+3O2+2H2O═4HNO3可知,若剩余10mL气体为NO,则氧气为(20mL-10mL)×$\frac{3}{4}$=7.5mL,
若剩余10mL气体为氧气,则20mLNO完全转化为硝酸,故氧气体积为:20mL×$\frac{3}{4}$+10mL=25mL,
故选AD.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应后剩余气体组成为解答关键,注意掌握一氧化氮与氧气、水反应的总方程式及讨论法在化学计算中的应用.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
13.下列过程中,不需要破坏化学键的是( )
| A. | 氯化钠溶于水 | B. | 氯化氢溶于水 | C. | 干冰汽化 | D. | 加热分解氯化铵 |
14.下列化学用语的表示不正确的是( )
| A. | S2-的结构示意图: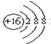 | B. | 氯气的电子式:Cl:Cl | ||
| C. | 氧-18的原子符号:${\;}_{8}^{18}$O | D. | CO2分子的结构式:O=C=O |
18.几种短周期元素的原子半径及主要化合价如下表,下列叙述不正确的是( )
| 元素代号 | X | Y | Z | W | T |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.074 | 0.071 |
| 主要化合价 | +1 | +3 | +6、-2 | -2 | -1、无正价 |
| A. | X与W形成的化合物中都只含离子键 | |
| B. | Z的氢化物与T的单质具有相同的核外电子数 | |
| C. | Y、X的最高价氧化物的水化物之间能反应 | |
| D. | Z的氧化物不止一种 |
15.某一反应物的浓度是2.0mol•L-1,经过2min后,它的浓度变成了1.56mol•L-1,则在这2min内它的平均反应速率为( )
| A. | 0.22 mol•(L•min)-1 | B. | 0.1 mol•(L•min)-1 | ||
| C. | 0.04 mol•(L•min)-1 | D. | 0.08 mol•(L•min)-1 |
12.下列各种用途中,利用了物质的氧化性的是( )
| A. | 用食盐腌制食物 | B. | 用盐酸除去铁钉表面的铁锈 | ||
| C. | 用液氨作制冷剂 | D. | 用漂粉精消毒游泳池中的水 |
13.化学反应A(g)+3B(g)=2C(g)+2D(g),下列四个选项是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是( )
| A. | υ(A)=0.20mol/(L•min) | B. | υ(B)=0.45 mol/(L•min) | ||
| C. | υ(C)=0.30 mol/(L•min) | D. | υ(D)=0.35 mol/(L•min) |