题目内容
8.将1mol N2和3mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率.①v(N2)=0.15mol/(L•min) ②v(N2)=1.05mol/(L•min) ③v(NH3)=0.30mol/(L•min),其中正确的是( )| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
分析 前半分钟内 v(H2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(3-2.1)mol}{4L}}{0.5min}$=0.45 mol•L-1•min-1,同一可逆反应同一时间内,各物质的反应速率之比等于其计量数之比,据此计算氮气、氨气反应速率,据此分析解答.
解答 解:前半分钟内 v(H2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(3-2.1)mol}{4L}}{0.5min}$=0.45 mol•L-1•min-1,同一可逆反应同一时间内,各物质的反应速率之比等于其计量数之比,
v(N2)=$\frac{1}{3}$×v(H2)=$\frac{1}{3}$×0.45 mol•L-1•min-1=0.15mol•L-1•min-1;
v(NH3)=$\frac{2}{3}$×v(H2)=$\frac{2}{3}$×0.45 mol•L-1•min-1=0.30 mol•L-1•min-1,
故选C.
点评 本题考查化学反应速率的有关计算,侧重考查分析解答能力,明确计量数与速率关系是解本题关键,注意速率公式中各个字母含义,题目难度不大.

练习册系列答案
相关题目
19.用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是( )
| A. | 加热 | B. | 滴加少量的CuSO4溶液 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 不用铁片,改用铁粉 |
3.将充满20mL NO试管倒置于盛有蒸馏水的烧杯中,然后向试管中通入纯O2,当试管内液面稳定在试管容积的一半时,则通入O2可能为( )
| A. | 25.0mL | B. | 35.0mL | C. | 17.5mL | D. | 7.5mL |
13.下列叙述正确的是(( )
| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO3与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
20.某些不合格的建筑装饰材料,会缓慢的释放出浓度过高,影响人体健康的气体,这些气体最常见的是( )
| A. | 二氧化氮 | B. | 二氧化硫 | ||
| C. | 一氧化氮 | D. | 甲醛和苯、甲苯等有机物气体 |
17.反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.4mol/(L•min) | D. | v(D)=0.0075 mol/(L•s) |
18.氢原子的电子云图中的小黑点表示的意义是( )
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
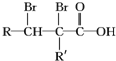 ,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).
,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).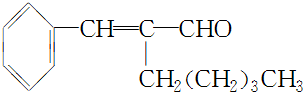 .
. +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH
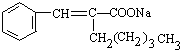 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.