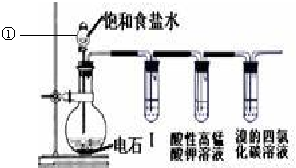
题目内容
14.下列化学用语的表示不正确的是( )| A. | S2-的结构示意图: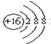 | B. | 氯气的电子式:Cl:Cl | ||
| C. | 氧-18的原子符号:${\;}_{8}^{18}$O | D. | CO2分子的结构式:O=C=O |
分析 A.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
B.氯气的电子式中漏掉了3对孤对电子;
C.元素符号的左上角为质量数、左下角为质子数;
D.二氧化碳分子中含有两个碳氧双键,用短线代替所有共用电子对即为结构式.
解答 解:A.硫离子的核电荷数为16,最外层有8个电子,其结构示意图为 ,故A正确;
,故A正确;
B.氯气分子中存在1个氯氯共用电子对,氯气正确的电子式为 ,故B错误;
,故B错误;
C.氧元素的质量数为8,氧-18的原子符号为${\;}_{8}^{18}$O,故C正确;
D.二氧化碳分子中含有两个碳氧双键,其结构式为O=C=O,故D正确;
故选B.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握电子式、离子结构示意图、结构式、元素符号等化学用语的概念及书写原则,试题培养了学生规范答题的能力.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
5.如表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)非金属性最强的是F(填元素符号)、化学性质最不活泼的是Ar(填元素符号).
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: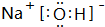 或
或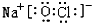 .
.
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(4)表中能形成两性氢氧化物的元素是Al(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强.
| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
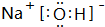 或
或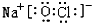 .
.(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(4)表中能形成两性氢氧化物的元素是Al(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强.
9.下列醇能被氧化为醛类化合物的是( )
| A. | (CH3)3COH | B. | 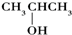 | C. | 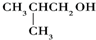 | D. | CH3CH2CH(CH3)OH |
19.用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是( )
| A. | 加热 | B. | 滴加少量的CuSO4溶液 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 不用铁片,改用铁粉 |
6.下列关于晶体的说法正确的组合是( )
①离子晶体中都存在离子键,肯定没有共价键
②分子晶体中都存在共价键,肯定没有离子键
③金刚石、SiC、NaF、NaCl、H2O、H2Se晶体的熔点依次降低
④在晶体中只要有阴离子就一定有阳离子
⑤金属晶体的熔点普遍都很高
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦分子晶体中分子间作用力越大,分子越稳定.
①离子晶体中都存在离子键,肯定没有共价键
②分子晶体中都存在共价键,肯定没有离子键
③金刚石、SiC、NaF、NaCl、H2O、H2Se晶体的熔点依次降低
④在晶体中只要有阴离子就一定有阳离子
⑤金属晶体的熔点普遍都很高
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦分子晶体中分子间作用力越大,分子越稳定.
| A. | ①②③⑥ | B. | ②④⑥ | C. | ③⑤⑥⑦ | D. | ③④ |
3.将充满20mL NO试管倒置于盛有蒸馏水的烧杯中,然后向试管中通入纯O2,当试管内液面稳定在试管容积的一半时,则通入O2可能为( )
| A. | 25.0mL | B. | 35.0mL | C. | 17.5mL | D. | 7.5mL |