题目内容
11.已知3Fe3O4+28HNO3(稀)═9Fe(NO3)3+14H2O+NO↑下列说法正确的是( )| A. | Fe3O4是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1mol NO,则转移电子数为2mol | |
| C. | 参加反应的氧化剂与还原剂的物质的最之比为28:3 | |
| D. | 若有3mol Fe3O4被氧化,则被还原的HNO3为1mol |
分析 Fe3O4中Fe元素的化合价有+2价、+3价,可被硝酸氧化成+3价,所以铁部分被氧化,反应中硝酸表现为酸性和氧化性,结合元素化合价的变化解答该题.
解答 解:Fe3O4中Fe元素的化合价有+2价、+3价,可被硝酸氧化成+3价,所以铁部分被氧化,反应中硝酸表现为酸性和氧化性,
A.根据以上分析,HNO3(稀)为氧化剂,Fe3O4是还原剂,故A错误;
B.生成1molNO,转移电子数为1mol×(5-2)=3mol,故B错误;
C.由生成物Fe(NO3)3和NO可知,硝酸在反应中表现为酸性和氧化性,则28mol参与反应,只有1mol作氧化性,所以参加反应的氧化剂与还原剂的物质的量之比为1:3=1:3,故C错误;
D.由生成物Fe(NO3)3和NO可知,硝酸在反应中表现为酸性和氧化性,则28mol参与反应,只有1mol作氧化性,所以根据反应方程式有3mol Fe3O4被氧化,则被还原的HNO3为1mol,故D正确.
故选D.
点评 本题考查氧化还原反应,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度分析相关概念和认识物质具有的性质,注意四氧化三铁中铁元素的化合价,为解答该题的关键,也是易错点,难度中等.

练习册系列答案
相关题目
19.用NA表示阿佛加德罗常数,下列说法不正确的是( )
| A. | 标准状态下的辛烷22.4L完全燃烧产生CO2分子数为8NA | |
| B. | 18克水所含的电子数为10NA | |
| C. | 46克NO2和46克N2O4中所含原子数均为3NA | |
| D. | 1L2molL的Mg(NO3)2溶液中含NO3个数为4NA |
16.下列说法正确的是( )
| A. | 油脂有油和脂肪之分,但都属于酯 | |
| B. | 糖类、油脂、蛋白质都能发生水解反应 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物 | |
| D. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成 |
20.已知锌能溶解在NaOH溶液中,产生H2.某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6mol/L NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片用水冲洗、烘干后称量,得质量为m2.下列说法正确的是( )
| A. | 设锌镀层厚度为h,锌的密度为ρ,则$\frac{{{m_1}-{m_2}}}{ρS}$=h | |
| B. | 锌电极上发生还原反应 | |
| C. | 锌和石墨形成原电池,外电路中电流从锌流向石墨 | |
| D. | 当石墨不再产生气泡时,应立即取出铁皮 |
1.短周期主族元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为19.X的简单阴离子比W的简单阴离子少2层电子,Y与Z位于相邻周期,Z的氧化物排放到空气中会形成酸雨.下列说法正确的是( )
| A. | 四种元素中,元素Z的非金属性最强 | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | Y、Z、W三种元素的原子半径大小顺序:r(W)>r(Z)>r(Y) | |
| D. | YW3、ZW2、Z2W2中各原子最外层均达到8电子稳定结构 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答: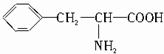 ,B的结构简式为
,B的结构简式为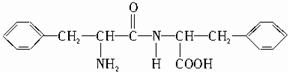 .
.