题目内容
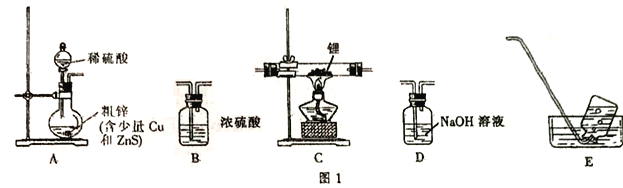
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。用下图所示装置进行第一组实验。
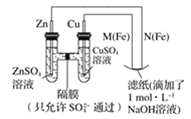
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是_____(填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N 极发生反应的电极反应式为______。
【答案】A 2H++2e-=H2↑(或2H2O+2e﹣=H2↑+2OH﹣)
【解析】
图中,左边装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,如果要找电极材料代替铜,所找材料必须是不如锌活泼的金属或导电的非金属,M是阳极,N是阴极,电解池中阴极上阳离子得电子发生还原反应,原电池放电时,阴离子向负极移动,据此分析。
(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,故答案为:A;
(2)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑(或2H2O+2e﹣=H2↑+2OH﹣),故答案为:2H++2e-=H2↑(或2H2O+2e﹣=H2↑+2OH﹣)。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
I.现有反应:①![]() ,②
,②![]() 。
。
(1)两反应中属于吸热反应的是______![]() 填序号
填序号![]() 。
。
(2)![]() 原电池的装置如图所示。
原电池的装置如图所示。

①溶液中![]() 向______
向______![]() 填“铁”或“铜”
填“铁”或“铜”![]() 电极方向移动。
电极方向移动。
②正极的现象是______,负极的电极反应式为______。
![]() 某可逆反应:
某可逆反应:![]() 在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 |
|
|
|
|
|
| |
2 | 800 |
|
|
|
|
|
|
|
3 | 950 |
|
|
|
|
|
|
|
(3)实验1中,在![]() min内,以物质A表示的平均反应速率为______
min内,以物质A表示的平均反应速率为______![]() ,50min时,
,50min时,![]() 正
正![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 逆
逆![]() 。
。
(4)0~20min内,实验2比实验1的反应速率______![]() 填“快”或“慢”
填“快”或“慢”![]() ,其原因可能是______。
,其原因可能是______。
(5)实验3比实验1的反应速率快,其原因是______。