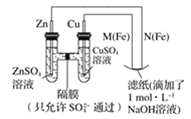
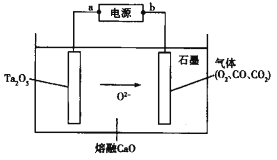
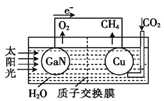
��Ŀ����
����Ŀ�������£���20mL0.1mol/L��ˮ����μ���0.1mol/L���ᣬ�����Һ��pH��������������仯��ͼ��ʾ������˵����ȷ����( )
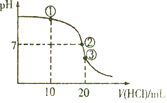
A.����Һ�У�c(Cl��)=2c(NH4+)+2c(NH3��H2O)
B.����Һ�У�c(NH4+)= c(Cl��)= c(OH��)= c(H+)
C.����Һ�У�c(H+)= c(OH��)+ c(NH4+)+c(NH3��H2O)
D.�ζ������п��ܳ��֣�c(NH3��H2O)��c(NH4+)��c(OH��)��c(Cl��)��c(H+)
���𰸡�D
��������
A. ����Һ�м���10mL������ʱ����ҺΪ�����ʵ����İ�ˮ���Ȼ�泥�2c(Cl��)= c(NH4+)+c(NH3��H2O)��A����
B. ����Һ��pH=7������ҺΪ�Ȼ�狀Ͱ�ˮ�Ļ����Һ����笠����ӵ�Ũ��ԶԶ������Һ��������Ũ�ȣ�c(NH4+)= c(Cl��) c(OH��)= c(H+)��B����
C. ����ҺΪ�Ȼ����Һ�����������غ��֪��c(H+)= c(OH��)+ c(NH3��H2O)��C����
D. �ζ������е�NH3��H2O���ʵ����϶࣬�����HCl����ʱ������NH4C1��������Һ��NH3��H2OŨ��Զ����NH4C1Ũ�ȣ����ܳ��֣�c(NH3��H2O)��c(NH4+)��c(OH��)��c(Cl��)��c(H+)��D��ȷ��
��ΪD��

��ϰ��ϵ�д�
�����Ŀ