题目内容
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):
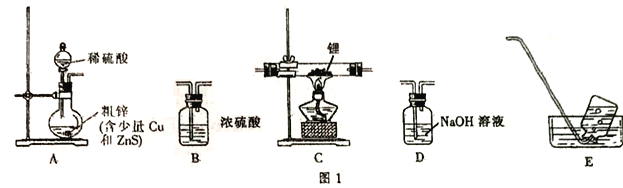
(1)装置的连接顺序(从左至右)为A→______________。
(2)检在好装蹬装置的气密性,点燃酒精灯前需进行的实验操作是_______________。
(3)写出制备氢化铝锂的化学方程式:__________________。
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。
(4)写出氢化锂与无水三氯化铝反应的化学方程式:____________________。
III.测定氢化铝锂产品(不含氢化锂)的纯度
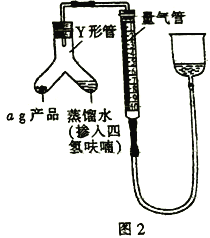
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是________。读数之前上下移动量气管右侧的容器,使量气管左、右有两侧的液面在同一水平面上,其目的是_________。
(6)在标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将________(填“偏高”“偏低”或“无影响”)。
【答案】 D→B→C→B→E 打开装置A中分液漏斗的活塞,一段时间后,用小试管在装置E的水槽中收集气体并验纯 2Li+H2![]() 2LiH 4LiH+AlCl3=LiAlH4+3LiCl 倾斜Y形管,将蒸馏水(掺入四氢呋喃)全部注入ag产品中 确保量气管内气体的压强与大气压强相等
2LiH 4LiH+AlCl3=LiAlH4+3LiCl 倾斜Y形管,将蒸馏水(掺入四氢呋喃)全部注入ag产品中 确保量气管内气体的压强与大气压强相等 ![]() 偏高
偏高
【解析】I. (1) 氢化锂遇水能够剧烈反应,因此生成的氢气需要干燥,并除去其中混有的H2S,因此需要显通过氢氧化钠溶液除去硫化氢气体,再通过浓硫酸干燥,然后在C装置中发生反应生成氢化锂,为防止外界水蒸气进入装置,后面需要接干燥装置B,最后用排水集气法收集未反应的氢气,装置的连接顺序(从左至右)为A→D→B→C→B→E,故答案为:D→B→C→B→E;
(2)检查好装置的气密性,点燃酒精灯前需要首先制备氢气,并检验氢气的纯度,因此进行的实验操作为打开装置A中分液漏斗的活塞,一段时间后,用小试管在装置E的水槽中收集气体并验纯,故答案为:打开装置A中分液漏斗的活塞,一段时间后,用小试管在装置E的水槽中收集气体并验纯;
(3)氢气与锂反应制备氢化锂的化学方程式为,故答案为:2Li+H2![]() 2LiH;
2LiH;
II. (4) 氢化锂与无水三氯化铝按一定比例在乙醚中混合,充分反应得到LiAlH4,反应的化学方程式为4LiH+AlCl3=LiAlH4+3LiCl,故答案为:4LiH+AlCl3=LiAlH4+3LiCl;
III. (5)按图2装配仪器、检查装置气密性并装好药品,Y形管中的蒸馏水足量,启动反应时只需要倾斜Y形管,将蒸馏水(掺入四氢呋喃)全部注入a g产品中即可。读数之前,上下移动量气管右侧的容器,使量气管左、右两侧的液面在同一水下面上,可以确保量气管内气体的压强与大气压强相等,减少实验误差,故答案为:倾斜Y形管,将蒸馏水(掺入四氢呋喃)全部注入a g产品中,确保量气管内气体的压强与大气压强相等;
(6) 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体为氢气,LiAlH4+4H2O=LiOH+ Al(OH)3+4H2↑,在标准状况下,反应前量气管读数为VmL,反应完毕并冷却之后,量气管读数为V2mL,则生成的氢气为(V2-V1)mL,根据方程式,LiAlH4的物质的量为![]() ×
×![]() ,则样品的纯度 =
,则样品的纯度 = ×100%=
×100%=![]() %,如果起始读数时俯视刻度线,导致V1偏小,结果偏高,故答案为:
%,如果起始读数时俯视刻度线,导致V1偏小,结果偏高,故答案为: ![]() %;偏高。
%;偏高。

【题目】根据所学知识填空。
(1)用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.Fe还原水体中NO3﹣的反应原理如图所示. 
①作负极的物质是 .
②正极的电极反应式是 .
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如表:
化学键 | H﹣H | C﹣O | C﹣O | H﹣O | C﹣H |
E/(KJmol﹣1) | 436 | 343 | 1075 | 465 | 413 |
由此计算△H1=kJmol﹣1 . 已知△H2=﹣58kJmol﹣1 , 则△H3=kJmol﹣1 .
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量