题目内容
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-283.0 kJmol-1;
O2(g)=CO2(g) △H=-283.0 kJmol-1;
H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1;
O2(g)=H2O(l) △H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g) △H=___kJmol-1。
CH3OH(g) △H=___kJmol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___(填写序号)。
a.使用催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
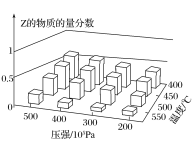
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示。
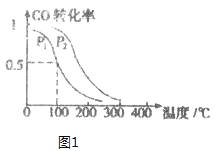
①P1___P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=______;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2、CH3OH各0.5a mol,则平衡___(填“向左”“不”或“想右”)移动。
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___;
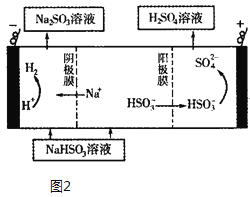
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______。用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液,电解原理示意图如图2所示。请写出该电解池发生反应的化学方程式___。
【答案】-90.1 ac 小于 ![]() 向左 SO2-2e-+2H2O=SO42-+4H+ 6.2×10-4 mol/L 2NaHSO3+H2O
向左 SO2-2e-+2H2O=SO42-+4H+ 6.2×10-4 mol/L 2NaHSO3+H2O![]() Na2SO3+H2SO4+H2↑
Na2SO3+H2SO4+H2↑
【解析】
(1)已知:
①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJ/mol;
②CO(g)+![]() O2(g)=CO2(g) △H=-283.0 kJ/mol;
O2(g)=CO2(g) △H=-283.0 kJ/mol;
③H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ/mol;
O2(g)=H2O(l) △H=-285.8 kJ/mol;
由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)![]() CH3OH(g),△H=-283.0 kJ/mol-285.8 kJ/mol×2+764.5 kJ/mol=-90.1 kJ/mol;
CH3OH(g),△H=-283.0 kJ/mol-285.8 kJ/mol×2+764.5 kJ/mol=-90.1 kJ/mol;
(2)温度越高、压强越大,使用催化剂都可使反应速率增大,降低温度反应速率减慢,从体系中分离出甲醇,相当于减少浓度,反应速率减慢,故合理选项为ac;
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)![]() CH3OH(g)可知压强越大,越有利于平衡向正反应进行,所以压强P1<P2;
CH3OH(g)可知压强越大,越有利于平衡向正反应进行,所以压强P1<P2;
②由于平衡常数与压强没有关系,所以根据图象可知,在100℃P1时,CO的转化率是0.5,则由反应CO(g)+2H2(g)![]() CH3OH(g)可知:起始时,n(CO)=
CH3OH(g)可知:起始时,n(CO)=![]() mol/L,n(H2)=
mol/L,n(H2)=![]() mol/L,n(CH3OH)=0;由转化率是0.5,则平衡时,n(CO)=
mol/L,n(CH3OH)=0;由转化率是0.5,则平衡时,n(CO)=![]() mol/L,n(H2)=
mol/L,n(H2)=![]() mol/L,n(CH3OH)=
mol/L,n(CH3OH)=![]() mol/L,所以平衡常数K=
mol/L,所以平衡常数K=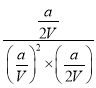 =
=![]() ;
;
③在其它条件不变的情况下,向容器中通入CO、H2、CH3OH各0.5a mol,等效为减小氢气的浓度,则平衡向逆反应移动,即平衡向左移动;
(4)该原电池中,负极上失电子被氧化,二氧化硫转化为硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O=SO42-+4H+;
(5)Na2SO3溶液的浓度为2×10-3 mol/L,等体积混合后溶液中c(SO32-)=![]() ×2×10-3 mol/L=1×10-3 mol/L,根据Ksp=c(SO32-)c(Ca2+)=3.1×10-7可知,c(Ca2+)=
×2×10-3 mol/L=1×10-3 mol/L,根据Ksp=c(SO32-)c(Ca2+)=3.1×10-7可知,c(Ca2+)=![]() mol/L=3.1×10-4 mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为6.2×10-4 mol/L,阳极是亚硫酸氢根氧化成硫酸根,而阴极是水中的氢离子放电生成氢气,所以总的电解反应方程式为2NaHSO3+H2O
mol/L=3.1×10-4 mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为6.2×10-4 mol/L,阳极是亚硫酸氢根氧化成硫酸根,而阴极是水中的氢离子放电生成氢气,所以总的电解反应方程式为2NaHSO3+H2O![]() Na2SO3+H2SO4+H2↑。
Na2SO3+H2SO4+H2↑。

 阅读快车系列答案
阅读快车系列答案