题目内容
【题目】砷(33As)在周期表中与氮同主族,砷及其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷化氢的电子式为_________。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是一种两性氧化物,写出As2O3溶于浓盐酸的化学方程式_____________________。
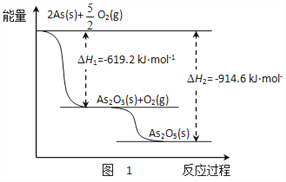
(3)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式________________________________________。
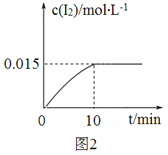
(4)砷酸钠(Na3AsO4)具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①0~10 min内,I的反应速率v(I)=______________。
②在该条件下,上述反应的平衡常数K=__________。
③升高温度,溶液中AsO43-的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(5)己知砷酸(H3ASO4)是三元酸,有较强的氧化性。
①常温下砷酸的Ka1=6×10-3、Ka2=1×10-7,则 NaH2AsO4溶液中c(HAsO42-)___c(H3AsO4)(填“>”、“<”或“=”)。
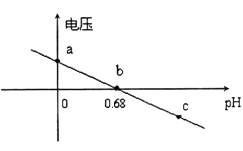
②某实验小组依据反应AsO43-+2H++2I-AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得输出电压与pH的关系如图。则a点时,盐桥中K+____移动(填“向左”、“向右”或“不”),c点时,负极的电极反应为____________________。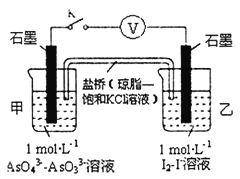
【答案】 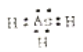 As2O3+6HCl(浓)=2AsCl3+3H2O
As2O3+6HCl(浓)=2AsCl3+3H2O ![]() 0.003mol/(L·min) 4.5×106 小于 > 向左 AsO33--+H2O-2e-=AsO43-+2H+
0.003mol/(L·min) 4.5×106 小于 > 向左 AsO33--+H2O-2e-=AsO43-+2H+
【解析】(1)砷(33As)在周期表中与氮同主族, 砷化氢的分子式为AsH3,,则砷化氢的电子式为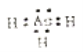 。
。
(2)As2O3是一种两性氧化物,则As2O3溶于浓盐酸反应生成氯化砷和水,所以化学方程式为As2O3+6HCl(浓)=2AsCl3+3H2O。
(3)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1知
As2O5(s)=2As(s)+5/2O2(g) ΔH = +914.6KJ/mol, ,As2O3(s)=2As(s)+3/2O2(g) ΔH =+619.2 KJ/mol, ,所以As2O5分解为As2O3的热化学方程式![]()
(4)①如图2 在0~10 min内,I2的反应速率v(I2)=0.015mol.L-/10 min=0.0015mol.L-1. min-1
因为AsO43-(无色) + 2I- + 2H+![]() AsO33-(无色)+I2(浅黄色)+H2O知2I- ---- I2,根据化学反应计量数之比就等于速率之比,所以0~10 min内,I的反应速率v(I)=2 v(I2)=2
AsO33-(无色)+I2(浅黄色)+H2O知2I- ---- I2,根据化学反应计量数之比就等于速率之比,所以0~10 min内,I的反应速率v(I)=2 v(I2)=2![]() 0.0015mol.L-1. min-1=0..003mol/(L·min)
0.0015mol.L-1. min-1=0..003mol/(L·min)
②由 AsO43-(无色) + 2I- + 2H+ ![]() AsO33- (无色)+I2(浅黄色)+H2O
AsO33- (无色)+I2(浅黄色)+H2O
初始量(mol/L): 0.02 0.04 0.04 0 0 0
变化量(mol/L) 0.015 0.03 0.03 0.015 0.015
剩余量(mol/L) 0.005 0.01 0.01 0.015 0.015
反应的平衡常数K=0.0152/(0.005![]() 2
2![]() 0.012)= 4.5×106
0.012)= 4.5×106
③升高温度,溶液中AsO43-的平衡转化率减小,说明平衡逆向移动,所以该反应为放热反应的ΔH小于0。
(5)①常温下砷酸H3AsO4的Ka1=6×10-3、Ka2=1×10-7,所以H2AsO4-的水解程度小于电离程度则 NaH2AsO4溶液中c(HAsO42-)>c(H3AsO4)。
②某实验小组依据反应AsO43-+2H++2I-AsO33-+I2+H2O AsO43-为氧化剂得电子,做正极,2I-做还原剂,失电子,做负极,则a点时溶液显酸性,盐桥中K+向左移动,c点时平衡逆向移动,负极的电极反应为AsO33--+H2O-2e-=AsO43-+2H+。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案