题目内容
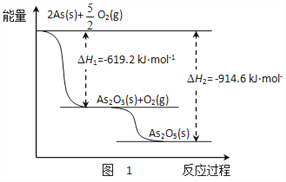
【题目】2SO2(g)+O2(g)![]() 2SO3(g) △H =-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO3+SO3(快);4VO2+O2→2V2O5(慢)
2SO3(g) △H =-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO3+SO3(快);4VO2+O2→2V2O5(慢)
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 该反应逆反应的活化能大于198kJ/mol D. 升高温度,该反应的△H增大
【答案】C
【解析】A. 因为V2O5为固体物质,反应速率与固体质量关系,故A错;B.催化剂是指能加速或延缓化学反应速度,而本身的重量和性质并不改变的物质,V2O5是该反应的催化剂,故B错;C.活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量,因为2SO2(g)+O2(g)=2SO3(g) △H =-198kJ/mol为放热反应,所以该反应逆反应的大于198kJ/mol,故C正确。D. 2SO2(g)+O2(g)=2SO3(g) △H =-198kJ/mol,此反应为放热反应,△H的大小与参与反应的SO2(g)和O2(g) 的量有关,所以D错;答案:C。

【题目】甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示).500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(molL﹣1)分别为0.8、0.1、0.3、0.15,则此时v正v逆(填“>”、“=”或“<”).
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.