题目内容
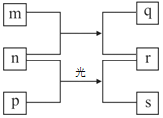
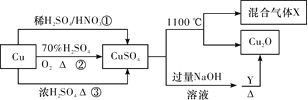
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
D. Y可以是葡萄糖
【答案】C
【解析】
由制备流程可以判断①中发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,②中发生2Cu+O2=2CuO、Cu+H2SO4(稀)=CuSO4+H2O;1100℃下Cu元素的化合价降低,则S、O元素的化合价也发生变化,反应为2CuSO4![]() Cu2O+SO2↑+O2↑,Y与氢氧化铜反应生成氧化亚铜,可以知道Y具有还原性,为含-CHO的有机物,以此来解答。
Cu2O+SO2↑+O2↑,Y与氢氧化铜反应生成氧化亚铜,可以知道Y具有还原性,为含-CHO的有机物,以此来解答。
A.葡萄糖含有醛基,能被新制氢氧化铜悬浊液氧化,氢氧化铜被还原为氧化亚铜,所以Y可为葡萄糖,A正确;
B.如途径①用混酸,Cu与混酸反应离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,因此所用混酸中H2SO4与HNO3物质的量之比最好为3∶2,B正确;
C.相对于途径①、③,途径②的优点是制取等质量胆矾需要的硫酸少、途径②无污染性气体产生,所以途径②更好地体现了绿色化学思想,C正确;
D.根据2CuSO4![]() Cu2O+SO2↑+O2↑可知1molCuSO4在1100℃分解,所得混合气体X中O2为0.5mol,D错误。
Cu2O+SO2↑+O2↑可知1molCuSO4在1100℃分解,所得混合气体X中O2为0.5mol,D错误。
答案选D。

练习册系列答案
相关题目