题目内容
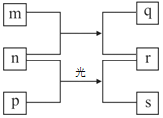
【题目】在一定温度下的密闭容器中,能判断反应X(s)+2Y(g) ![]() M(g)+N(g)达到最大限度的是( )
M(g)+N(g)达到最大限度的是( )
A. 压强不变
B. 生成M与N的物质的量之比为1:1
C. 生成1molM同时消耗2molY
D. 生成M的速率和消耗N的速率相等
【答案】D
【解析】根据化学平衡中“变量不变达平衡”进行判断,先找出物理量是否为变量,再进行判断。
A.无论该反应是否达到平衡状态,混合气体的压强始终不变,选项A错误;B.反应按计量数进行,只要反应开始,则生成M与N的物质的量之比始终为1:1,无法说明反应达平衡,选项B错误;C.无论该反应是否达到平衡状态,生成1molM同时一定消耗2molY,选项C错误;D. 生成M的速率和消耗N的速率相等,则正逆反应速率相等,反应达平衡,选项D正确。答案选D。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目