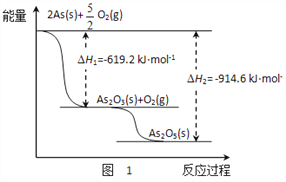
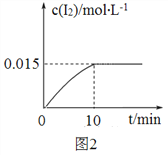
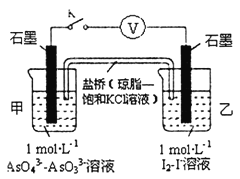
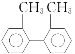
题目内容
【题目】向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示。下列说法正确的是
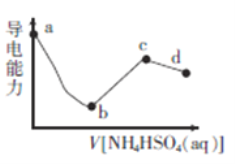
A. b点溶液中只存在H2O的电离平衡和BaSO4的沉淀溶解平衡
B. ab段反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O
C. C点溶液中:c(H+)+c(NH4+)=c(NH3·H2O)+c(OH-)
D. bc段之间存在某点,其溶液中:c(NH4+)=2c(SO42-)
【答案】D
【解析】b点时导电能力最弱,则![]() ,该点溶液中发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+H2O+NH3H2O,该点溶液中的溶质为NH3H2O,所以b点溶液中存在H2O 、NH3H2O的电离平衡和BaSO4的沉淀溶解平衡,A错误;根据以上分析,ab段反应的离子方程式为
,该点溶液中发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+H2O+NH3H2O,该点溶液中的溶质为NH3H2O,所以b点溶液中存在H2O 、NH3H2O的电离平衡和BaSO4的沉淀溶解平衡,A错误;根据以上分析,ab段反应的离子方程式为![]() ↓
↓![]()
![]() , B错误;c点时导电能力最强,
, B错误;c点时导电能力最强,![]() ,该点溶液中发生的反应为2NH4HSO4+ Ba(OH)2=BaSO4↓+2H2O+(NH4)2SO4,该点溶液中溶质为(NH4)2SO4,所以根据电荷守恒:
,该点溶液中发生的反应为2NH4HSO4+ Ba(OH)2=BaSO4↓+2H2O+(NH4)2SO4,该点溶液中溶质为(NH4)2SO4,所以根据电荷守恒:![]() ,又溶液
,又溶液![]()
![]() ,所以
,所以![]()
![]() , C错误;根据以上分析,b点溶液中的溶质为NH3H2O,显碱性,而c点溶液中溶质为(NH4)2SO4,水解显酸性,所以bc段之间存在某点,可以显中性,根据电荷守恒:
, C错误;根据以上分析,b点溶液中的溶质为NH3H2O,显碱性,而c点溶液中溶质为(NH4)2SO4,水解显酸性,所以bc段之间存在某点,可以显中性,根据电荷守恒:![]() ,则
,则![]() ,D正确;正确选项D。
,D正确;正确选项D。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示).500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(molL﹣1)分别为0.8、0.1、0.3、0.15,则此时v正v逆(填“>”、“=”或“<”).
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.